来自健康内皮细胞(Endothelial cells, ECs)释放的细胞外囊泡(EVs)已显示出促进血管生成的潜力,但它们的治疗效力仍然知之甚少。此前的研究显示,移植人类胚胎干细胞衍生的内皮细胞产品(hESC-ECP)有助于在小鼠急性缺血性疾病中促进新血管形成,而这可能通过一种旁分泌的机制实现。来自英国爱丁堡大学的研究人员发现,极低浓度的hESC-ECP 来源的EVs (hESC-eEVs)在体外促进EC管形成和伤口愈合,并发现了具有潜在新血管生成功能的EVs miRNAs(miR-4496,miR-4691-5p)。相关内容以“Extracellular vesicles from differentiated stem cells contain novel proangiogenic miRNAs and induce angiogenic responses at low doses”为题在线发表于12月13日的国际著名生物医学学术期刊Molecular Therapy上。
心血管疾病(Cardiovascular disease,CVD)仍然是全球最常见的死亡原因,根据世界卫生组织的报告,2017年有1790万人死于心血管疾病。在这些死亡中,估计有740万人仅因冠心病而死亡。冠心病的特征是冠状动脉逐渐形成血管壁狭窄和随后斑块破裂。这些动脉的阻塞导致下游组织缺氧和营养不足。因此,在心脏的受影响区域发生缺血性损害和心肌细胞死亡,这一现象被称为心肌梗死。治疗性新血管的重新生成已被提议作为一种可能的策略,从而创建新的心肌血管网络并减少心肌细胞损伤的程度。在这里,细胞间的旁分泌通信在该过程的控制中起着关键作用。以旁分泌方式进行的细胞通信由几种机制调节,包括细胞外囊泡(EVs)。EVs携带并传递各种生物活性分子,如小非编码RNA、蛋白质和脂质,这些分子调控受体细胞中的信号通路。
EV中的微小RNA(EV-miRNAs)由于调控了受体细胞中的分子过程,包括血管生成的能力,引起了巨大的关注。miRNAs是约22个核苷酸的小非编码RNA,被认为是基因表达的关键调节因子。关于miRNAs在EVs中的内源功能和可能的治疗价值存在很大争议。一些报道表明,大多数细胞外miRNAs通过与蛋白质(如AGO2)形成复合物而受到血浆核糖核酸酶的保护,而只有少数存在于EVs中。此外,许多研究已经证明, EV可以保护miRNAs免受血浆核糖核酸酶的降解,因此miRNAs可以被完整传递并内化到受体细胞中,通过抑制其靶点作为基因表达的新型调节因子。尽管有人提出了对某些miRNAs的非选择性分泌,但越来越多的证据表明,由于存在有助于它们与RNA结合蛋白结合的特定基序,miRNAs在EVs中是有选择地分选的。尽管存在争议,临床前研究已经证明EVs在调节复杂过程方面具有潜力,如缺血后新血管生成。然而,这些EVs的最佳来源、EVs载体和功能,以及EVs转化为临床应用的途径仍处于相对初期。
内皮细胞(EC)的损伤和激活是细胞释放EVs的重要因素。一般来说,在生理条件下,EC-EVs的浓度较低,而在激活时,从ECs中释放的EC-EVs的水平较高。从ECs释放的循环EVs已被证明在激活血管内皮细胞方面发挥作用。然而,新兴证据表明,源于内皮的EVs可能在新血管生成中发挥多功能角色,因为它们的效果不仅取决于EV-供体细胞,还取决于受体细胞暴露的EVs的剂量或数量。尽管在EC移植研究中提出了内皮细胞分泌物在EC激活和新血管生成中的潜在作用,显示在缺血组织中虽然作用有限,但在血管密度和血流改善方面显示出改进。
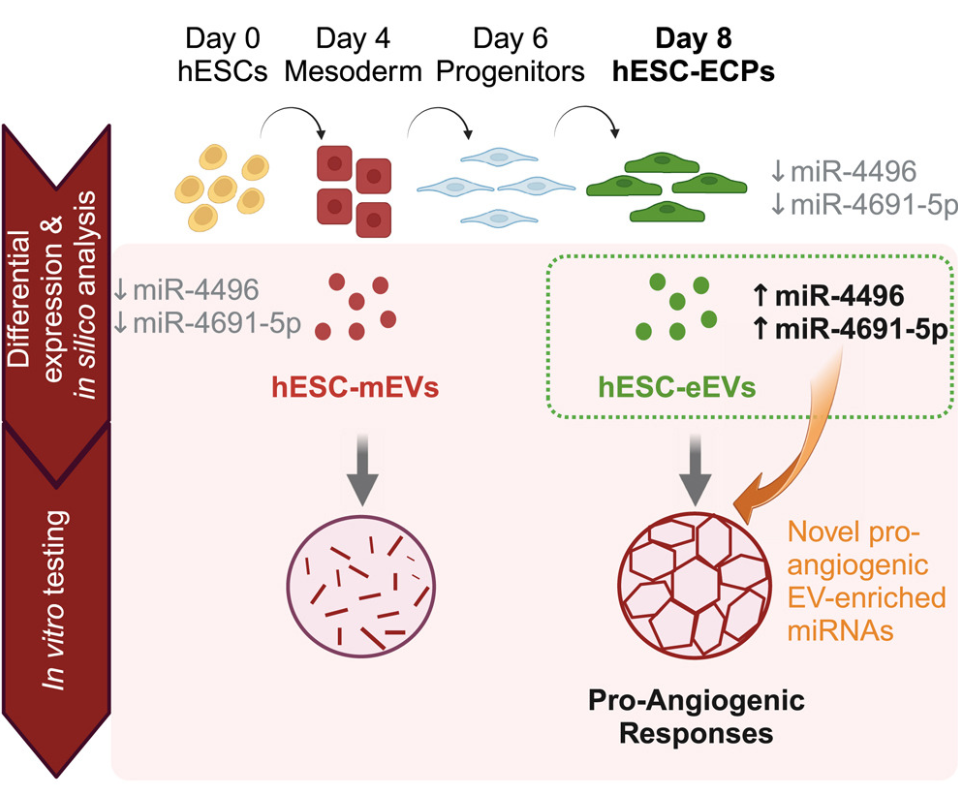
研究团队此前开发了一个高效的人类胚胎干细胞到EC分化方案,该方案持续产生约60%-70%的CD31+/CD144+ ECs,其余细胞表达外周细胞和间充质细胞标记,并表现出非残留多能性。在左股动脉阻塞后移植人类胚胎干细胞衍生的内皮细胞产品(hESC-ECP)产生了强有力的促血管生成反应,覆盖了一系列的小鼠模型。此外,在心肌缺血后注射hESC-ECP后改善了心脏功能,阐明了这些细胞作为一种治疗的广泛相关性。尽管这些细胞能够增加毛细血管密度,但它们显示出较差的保留率,提示可能涉及急性旁分泌机制。这些发现与先前的细胞移植研究一致,这些研究揭示了移植细胞中只有很少一部分能够植入到损伤部位。
由于hESC-ECP移植后增加的新血管生成速率暗示了旁分泌机制的作用,因此研究人员试图研究源于hESC-ECP的EVs(hESC-eEVs)对血管生成的影响。结果显示,hESC-eEVs在超低剂量下显著增加了体外EC管形成和伤口闭合,而更高剂量则无效。更重要的是,从分化的中胚层阶段分离的EVs(hESC-mEVs)没有效应。小RNA测序揭示了hESC-eEVs具有独特的转录谱,并富集了已知的促血管生成miRNA。此外,通过计算分析鉴定出三种潜在促血管生成功能的新的hESC-eEV-miRNAs。差异表达分析表明其中两者,miR-4496和miR-4691-5p,在hESC-eEVs中富集。miR-4496或miR-4691-5p的过表达导致体外EC管形成和伤口愈合的增加,验证了这些miRNAs的新颖促血管生成功能。总的来说,结果证明了hESC-eEVs在超低剂量下是EC血管生成反应的强效诱导剂,并包含了独特的EV相关miRNA谱系,其中包括具有新的促血管生成功能的miR-4496和miR-4691-5p。
参考文献:Extracellular vesicles from differentiated stem cells contain novel proangiogenic miRNAs and induce angiogenic responses at low doses. Mol Ther 2023. Doi:10.1016/j.ymthe.2023.11.023.