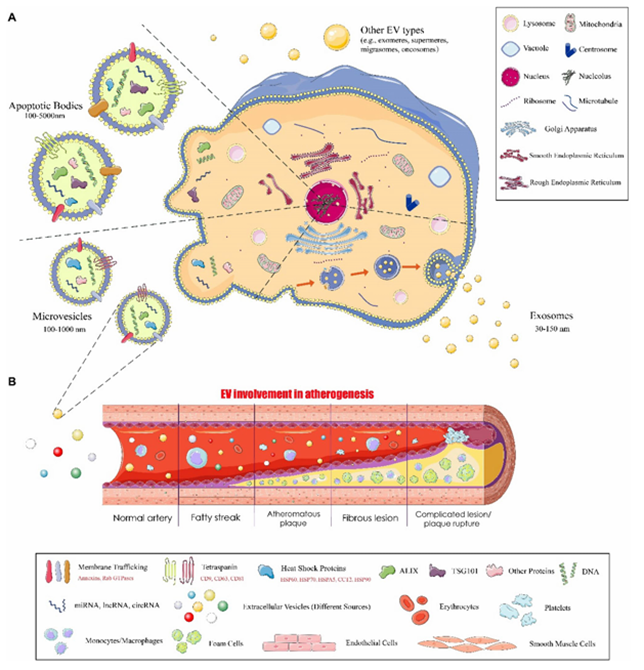
细胞外囊泡(EVs)是一类由细胞分泌的、具有磷脂双层膜结构的异质性囊泡。它们由包括原核生物和真核生物在内的多种生物体分泌,并且主要根据大小和生物发生过程被分为外泌体(exosomes)、微囊泡(microvesicles)、凋亡小体(apoptotic bodies)。这些囊泡在各种细胞功能中起着至关重要的作用,特别是在细胞间通讯中。
心血管疾病(CVD)是全球首要死因,动脉粥样硬化(AS)、缺血性心脏病、心力衰竭、主动脉病变和瓣膜病变等占CVD死亡的很大一部分。AS是一种慢性心血管疾病,以动脉内膜的脂质沉积和纤维化为特征,主要病理特征是动脉内斑块形成,伴有脂质积聚、局部炎症、血管平滑肌细胞增殖、凋亡、坏死和纤维化。越来越多的研究表明,胆固醇、甘油三酯和脂蛋白是AS的主要危险因素,而细胞外囊泡(EVs)携带的物质能够调节靶细胞的生理功能,如脂质沉积、表型变化、增殖和凋亡,从而参与动脉粥样硬化斑块的形成。因此,通过了解EVs在AS中的作用机制及其治疗应用,可揭示EVs在AS发病中的关键作用,并为开发基于EVs的新型诊断标志物和治疗策略提供重要依据。
南昌大学陈勇研究员团队在Angiogenesis杂志上发表题为“Diversity of extracellular vesicle sources in atherosclerosis: role and therapeutic application”的综述论文,主要介绍了不同细胞或不同疾病来源EVs对AS的影响,帮助读者从多维度探索EVs的作用机制和应用前景。第一作者张源,通讯作者陈勇。
该综述首先介绍EVs是一类由细胞分泌的磷脂双层膜结构,广泛参与细胞间通信和多种疾病的发生发展。动脉粥样硬化作为一种慢性心血管疾病,其病理特征包括脂质积聚、炎症反应和血管重塑。(图1)
图1 EVs的释放及其载物。(A)EV亚型(外泌体、微囊泡和凋亡小体)及其大致尺寸。(B)EV参与动脉粥样硬化发生
该综述对EVs在AS中的作用机制进行了归纳:不同细胞来源的EVs对AS的影响各异。例如,血小板源性EVs(PEVs)通过携带特定分子(如miR-34c-5p)抑制炎症反应;间充质干细胞源性EVs(MSC-EVs)通过调节巨噬细胞表型发挥抗AS作用;内皮细胞源性EVs(EC-EVs)中的miR-92a则促进泡沫细胞形成。这些发现揭示了EVs在AS中的复杂作用机制。同时概述了各种AS相关疾病如何通过EV影响动脉粥样硬化的发展。(图2)
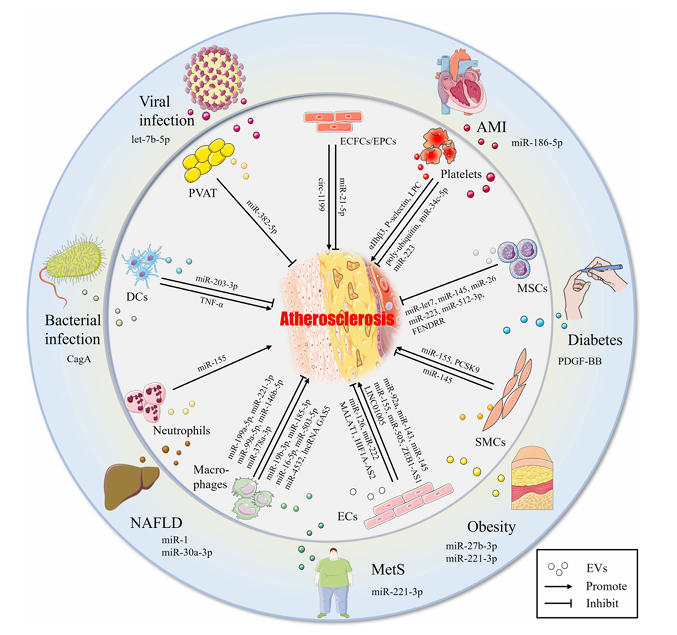
图2 不同细胞来源和AS相关的疾病来源EVs中的内源性货物
接着,该综述对EVs的治疗应用进行了归纳:通过工程化EVs或利用其靶向能力,可以开发新的治疗策略。例如,通过膜融合技术将血小板膜与MSC-EVs融合,提高EVs的靶向能力,从而更有效地将药物递送到病变部位,减轻AS程度。此外,通过基因治疗技术使ECs表达抗miR-33a-5p,减少miR-33a-5p在巨噬细胞和SMCs中的水平,增强胆固醇外流,也为AS治疗提供了新思路。
最后,综述强调了EVs的治疗价值。EVs可作为新型药物载体,与脂质体等结构相似,能高效递送药物至病变部位,如通过膜融合技术提高靶向能力,或结合脂质体创建工程化外泌体,增强治疗效果。饮食和生活方式对AS发展影响显著,特级初榨橄榄油(EVOO)和葵花籽油(SO)的饮食可改变EVs的miRNA组成,进而影响AS发展。而规律运动、尼古丁暴露和PM2.5暴露也能通过EVs调节AS。此外,多种药物通过EVs发挥治疗作用,如姜黄素、芍药醇、SGLT2i和GLP-1受体激动剂等,它们通过调节EVs的释放或其携带的分子,减轻炎症、抑制动脉粥样硬化形成。这些研究结果表明,EVs在AS治疗中具有广阔的应用前景,为开发新型治疗策略提供了重要依据。
该综述从不同细胞和不同疾病的角度深入探讨了EVs与AS千丝万缕的关系,旨在拓宽和加深对 AS 的理解,为未来针对AS及相关疾病的诊断、治疗和预防策略提供了新的思路和理论依据。
参考文献:
Diversity of extracellular vesicle sources in atherosclerosis: role and therapeutic application. Angiogenesis 28, 34 (2025). https://doi.org/10.1007/s10456-025-09983-7