细胞外囊泡(Extracellular vesicles,简称EVs)是一种纳米级的脂质囊泡,大小在30 - 150纳米之间,由细胞分泌后含有多种成分,如DNA、RNA、蛋白质、肽、脂质和碳水化合物等。循环的EVs通过将货物分子从供体细胞转移到受体细胞,在各种生理病理过程中发挥核心作用。特别是,EV相关的miRNAs被认为是重要的生物标志物,因为它们可以调节信使RNA (mRNA)的翻译,并密切参与各种癌症的发生和发展。
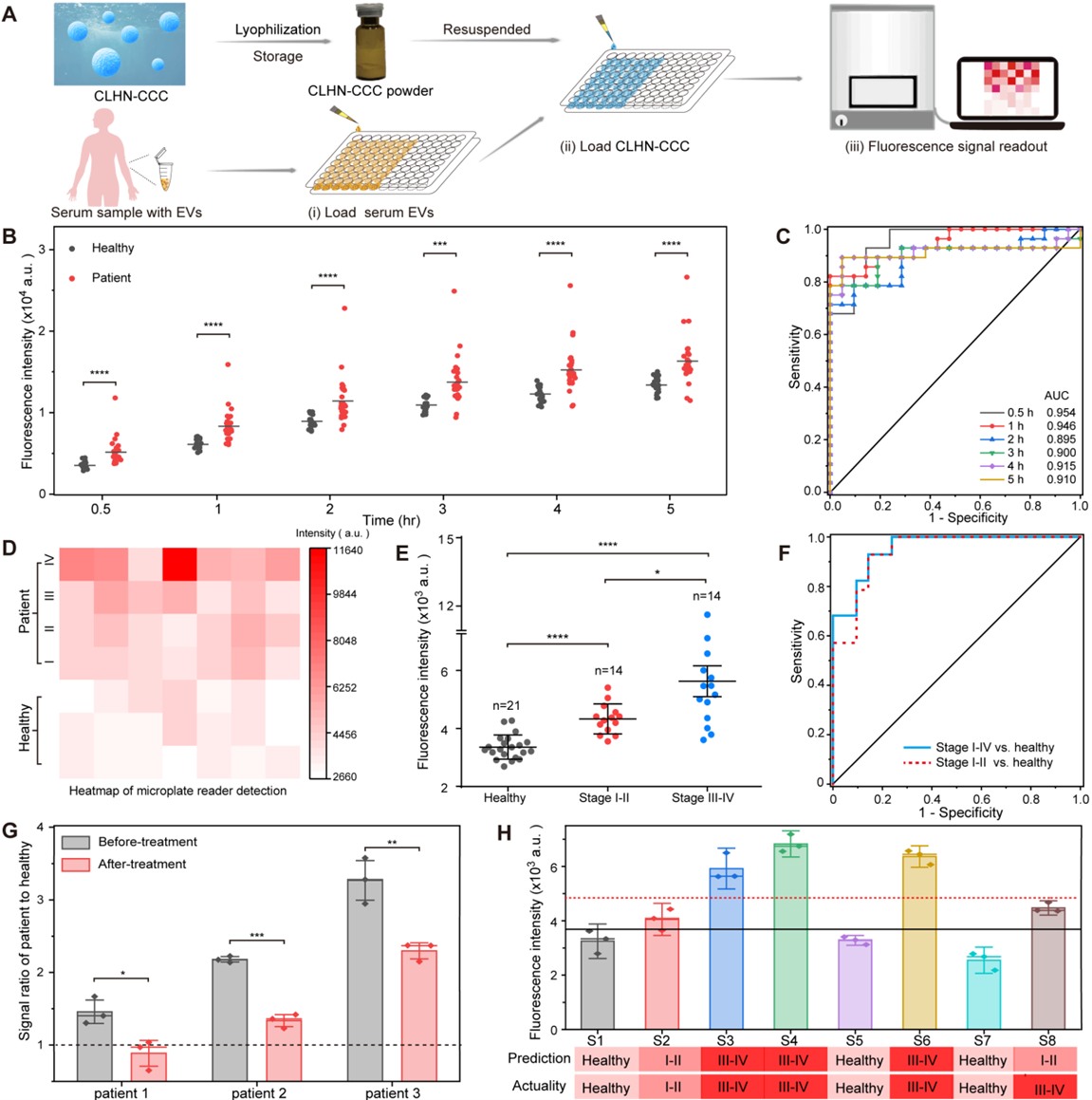
然而,由于外泌体中miRNA的丰度低以及EV脂质双分子层对miRNA的保护,直接检测EV相关的miRNA仍然是一个巨大的挑战。目前大多数技术手段需要对EVs进行预先富集,破膜提取RNA,以及后续的miRNA检测。增大了RNA样本降解风险的同时,繁琐和耗时的预处理流程也限制了其广泛和便携的应用。近年来,在不破坏EV的情况下,分子信标通过膜融合,细胞穿透肽、链球菌溶血素O,电穿孔,纳米耀斑等方式递送到EV内部的原位检测策略可以规避破膜提取RNA的弊端。然而,由于分子信标的灵敏度不够理想,大多数这些技术在递送前仍然需要冗长的EV富集(如,超速离心)。否则检测则需要依赖于昂贵且灵敏的大型仪器(如,全内反射荧光显微镜)。因此,迫切需要开发便携、快速和超灵敏的策略,以适应低成本的通用仪器,一步实现EV富集和内部miRNA的原位检测,实现无创癌症诊断。基于此,华南师范胡家铭、盛燕团队开发了一种封装催化发夹组装 (CHA) 级联CRISPR-Cas12a 系统(CCC)的阳离子脂质-聚合物杂化纳米颗粒(CLHN)诱导EV聚集和原位microRNA快速检测的技术(CLHN-CCC),相关工作以“Universal DNAzyme walkers-triggered CRISPR-Cas12a/Cas13a bioassay for the synchronous detection of two exosomal proteins and its application in intelligent diagnosis of cancer”为题发表在Biosensors and Bioelectronics上(2023 Jan 1:219:114827)上,该技术可以适用于小型商品化仪器(如,酶标仪),实现在30分钟内一步完成EV的富集和内部microRNA的原位检测。其中阳离子CLHN在三维空间中可以捕获溶液中90%以上的阴离子EVs,实现EV富集。同时,脂质间的融合与内容物的混合使得包封的二级放大器(CCC)在原位灵敏的量化EVs相关的miRNA靶标。
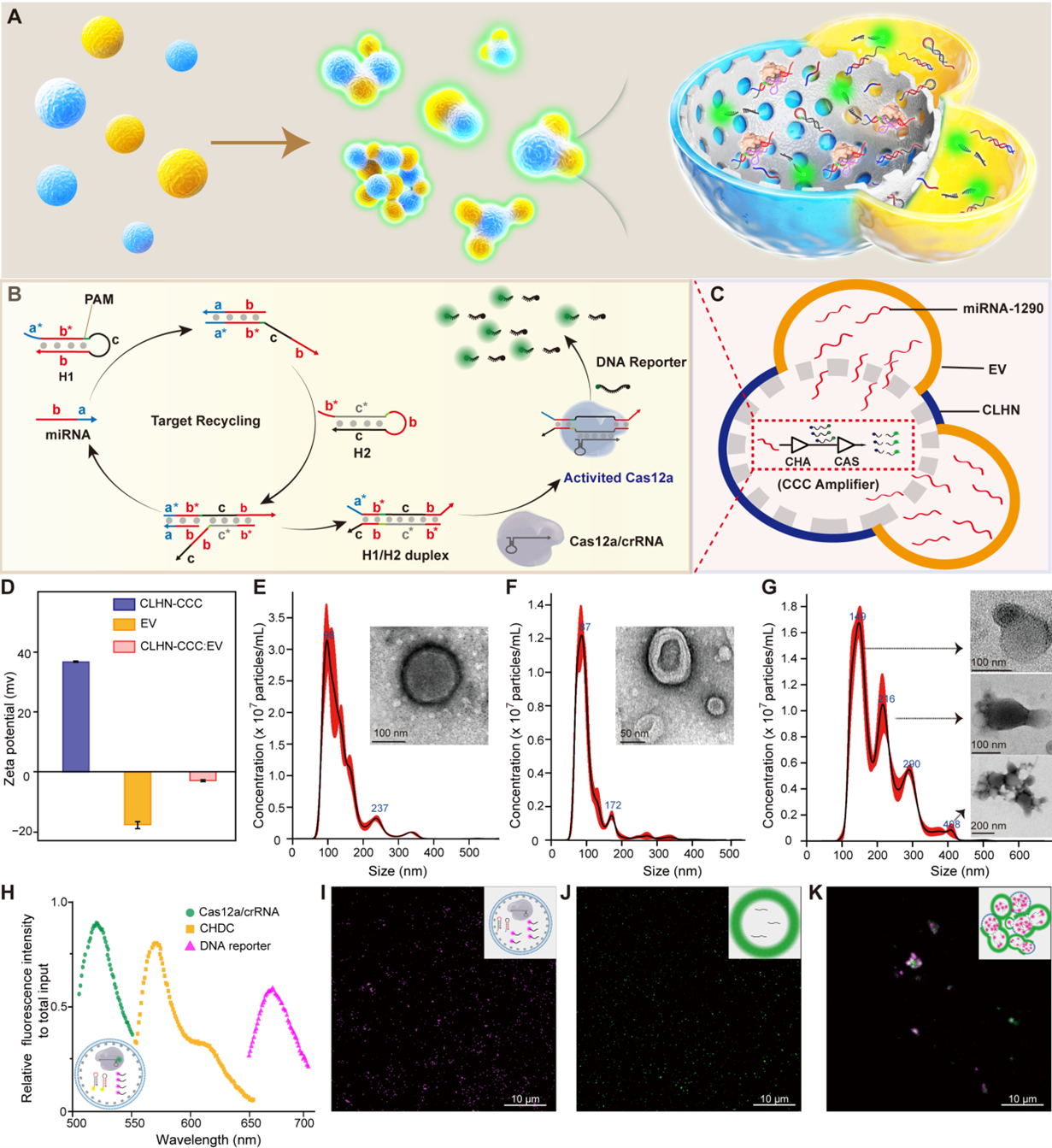 图1:CLHN-CCC的原理和表征与传统富集,破坏EV、提取和检测miRNA等多个步骤的方法相比,CLHN-CCC在EV的富集和融合以及EV相关RNA的原位检测方面具有独特的“一锅式”优势。具有核-壳-电晕结构的CLHN在保护和封装CCC,富集分离EV,为CCC与EV相关RNA的转运和反应提供通道和空间方面具有独特的优势。CLHN-CCC的富集效率(>90%)在人工EV、细胞分泌的EV和血清中的EV中得到了证明,是传统超速离心法的5倍。CHA与CRISPR-Cas12a系统级联的双放大器 — CCC,可以实现对游离miRNA-1290靶标的显著信号放大,LOD为1.5 fM。CLHN-CCC在对人工EV模型的测试中检出限可达0.07 amol miRNA-1290的人工EV(10个/μL)的检测,具有优异的灵敏度。EV富集和双放大器的联合作用使得该原位检测的方法可适用于小型的商品化酶标仪。经过冻干后,CLHN-CCC在6个月内没有明显的性能损失,使其更加便携和用户友好。当用人血清挑战时,重悬CLHN-CCC粉末检测早期胰腺癌的特异性、灵敏度和准确性分别达到85.7%、92.9%和88.6%。整个过程不需要昂贵复杂的设备,不需要专门培训的操作人员。值得注意的是,与需要在设备上集成各种模块进行EV富集和RNA检测的微流控或芯片技术不同,CLHN-CCC将所有功能集成在纳米颗粒上,大大降低了成本(0.15$/样品)并提高了用户友好性。总的来说,该技术具有高特异性、高灵敏度、低成本、检测时间短和易于扩展的优点,在早期癌症的常规护理点检测以及治疗监测中具有前景。图2:CLHN-CCC冻干粉对胰腺癌患者血清样本中细胞外囊泡miR-1290的检测该论文的第一作者为华南师范大学张腾化博士,通讯作者为华南师范大学生物光子学研究院胡家铭研究员和盛燕副教授。该研究得到了国家自然科学基金,广东省自然科学基金等项目支持。Universal DNAzyme walkers-triggered CRISPR-Cas12a/Cas13a bioassay for the synchronous detection of two exosomal proteins and its application in intelligent diagnosis of cancer. Biosens Bioelectron,2023 Jan 1:219:114827. doi: 10.1016/j.bios.2022.114827.原文链接:https://doi.org/10.1016/j.bios.2023.115856
图1:CLHN-CCC的原理和表征与传统富集,破坏EV、提取和检测miRNA等多个步骤的方法相比,CLHN-CCC在EV的富集和融合以及EV相关RNA的原位检测方面具有独特的“一锅式”优势。具有核-壳-电晕结构的CLHN在保护和封装CCC,富集分离EV,为CCC与EV相关RNA的转运和反应提供通道和空间方面具有独特的优势。CLHN-CCC的富集效率(>90%)在人工EV、细胞分泌的EV和血清中的EV中得到了证明,是传统超速离心法的5倍。CHA与CRISPR-Cas12a系统级联的双放大器 — CCC,可以实现对游离miRNA-1290靶标的显著信号放大,LOD为1.5 fM。CLHN-CCC在对人工EV模型的测试中检出限可达0.07 amol miRNA-1290的人工EV(10个/μL)的检测,具有优异的灵敏度。EV富集和双放大器的联合作用使得该原位检测的方法可适用于小型的商品化酶标仪。经过冻干后,CLHN-CCC在6个月内没有明显的性能损失,使其更加便携和用户友好。当用人血清挑战时,重悬CLHN-CCC粉末检测早期胰腺癌的特异性、灵敏度和准确性分别达到85.7%、92.9%和88.6%。整个过程不需要昂贵复杂的设备,不需要专门培训的操作人员。值得注意的是,与需要在设备上集成各种模块进行EV富集和RNA检测的微流控或芯片技术不同,CLHN-CCC将所有功能集成在纳米颗粒上,大大降低了成本(0.15$/样品)并提高了用户友好性。总的来说,该技术具有高特异性、高灵敏度、低成本、检测时间短和易于扩展的优点,在早期癌症的常规护理点检测以及治疗监测中具有前景。图2:CLHN-CCC冻干粉对胰腺癌患者血清样本中细胞外囊泡miR-1290的检测该论文的第一作者为华南师范大学张腾化博士,通讯作者为华南师范大学生物光子学研究院胡家铭研究员和盛燕副教授。该研究得到了国家自然科学基金,广东省自然科学基金等项目支持。Universal DNAzyme walkers-triggered CRISPR-Cas12a/Cas13a bioassay for the synchronous detection of two exosomal proteins and its application in intelligent diagnosis of cancer. Biosens Bioelectron,2023 Jan 1:219:114827. doi: 10.1016/j.bios.2022.114827.原文链接:https://doi.org/10.1016/j.bios.2023.115856外泌体资讯网 华南师范胡家铭/盛燕:CRISPR-Cas12a驱动的杂化纳米粒用于细胞外囊泡聚集和原位microRNA检测
 图1:CLHN-CCC的原理和表征
图1:CLHN-CCC的原理和表征