由高能创伤、肿瘤切除或感染并发症引起的大尺寸骨缺损是一项严峻的临床挑战。骨缺损部位的结构塌陷、供血不足以及持续的炎症级联反应严重阻碍了骨组织的再生。基于间充质干细胞来源外泌体(MSC-Exos)的无细胞疗法在组织修复中表现出巨大的再生潜力,但低靶向性和治疗效力不足限制了MSC-Exos在骨组织工程中的应用。天然提取的小分子药物姜黄素具有优异的抗菌、抗炎和抗氧化等生物活性,但低溶解性和生物利用度极大地制约了其临床适用性。
近期,中山大学生物医学工程学院张超教授团队在Materials Today Bio杂志上发表题为“Curcumin-encapsulated exosomes in bisphosphonate-modified hydrogel microspheres promote bone repair through macrophage polarization and DNA damage mitigation”的论文,主要介绍了通过内源性载药策略制备负载姜黄素的外泌体(Cur@Exos)并封装于双膦酸盐修饰的GelMA水凝胶微球中(CE@BP-Gel)用于骨缺损修复的治疗策略。该工作创新性的将脂溶性姜黄素与MSC-Exos结合,解决了姜黄素生物利用度低的问题,并提升了MSC-Exos的治疗效力。CE@BP-Gel通过免疫调节、成骨和血管生成协同作用,显著促进了大鼠颅骨临界尺寸骨缺损的修复。中山大学生物医学工程学院博士后司云晖、硕士研究生董树澳及中山大学材料科学与工程学院李梦莎博士为共同第一作者,张超教授为通讯作者。

原位注射的CE@BP-Gel在骨缺损部位持续释放Cur@Exos,其中姜黄素通过激活DNA损伤修复酶TDP1,增强巨噬细胞对活性氧诱导的DNA单链断裂的修复能力,减少γH2AX和53BP1等DNA损伤标志物的积累,从而抑制炎症环境中的M1型巨噬细胞极化并促进抗炎性M2型极化。同时,双膦酸盐组分直接抑制破骨细胞活性,而Cur@Exos通过携带的核酸和蛋白质组分上调骨髓间充质干细胞中成骨相关基因和蛋白的表达,并通过上调内皮细胞中血管生成因子的表达促进血管新生。这种免疫调节与成骨/血管生成的协同作用重塑了骨修复微环境,为骨组织工程提供了新的治疗策略。
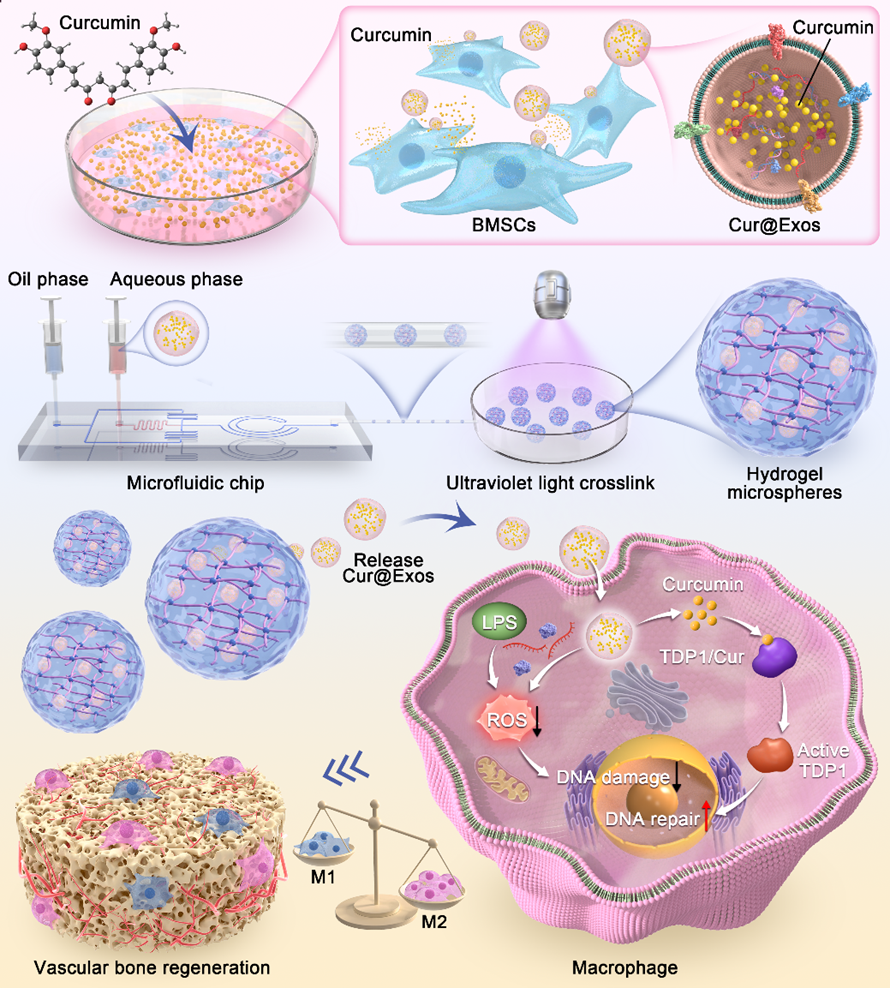
CE@BP-Gel微球制备路线及作用机制示意图
参考文献:
Curcumin-encapsulated exosomes in bisphosphonate-modified hydrogel microspheres promote bone repair through macrophage polarization and DNA damage mitigation, Materials Today Bio, 32 (2025) 101874.
外泌体资讯网 Materials Today Bio|中山大学张超:负载姜黄素的MSC-Exos通过调控巨噬细胞极化和减轻DNA损伤促进骨修复




