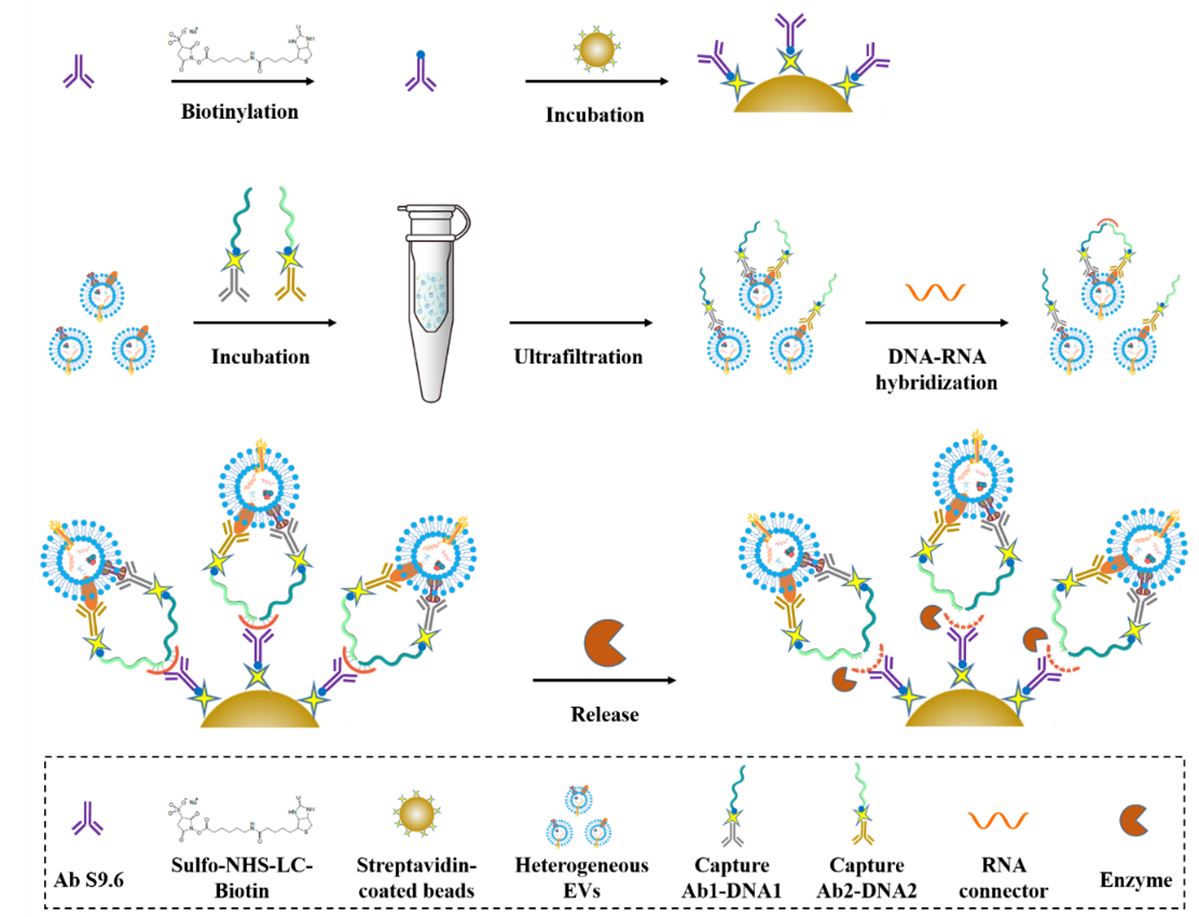
细胞外囊泡(Extracellular vesicles, EVs)是细胞向胞外分泌的一种直径为30-2000 nm的磷脂双层囊泡,是细胞间通讯的重要媒介,在肿瘤的发生发展中发挥着重要的作用,具有广阔的临床应用前景。然而,EVs异质性显著,给EVs的深入研究来了巨大的挑战。研究发现,对特定的蛋白阳性EV亚群进行分类和分析对于更准确地了解EV的生物学意义至关重要。尽管有研究学者根据单一蛋白标记来定义特定的EV亚群,但EV的显著异质性使得满足日益增长的精确分析需求变得越来越具有挑战性。因此,研究人员已经开始使用多种蛋白质标记,如双阳性膜蛋白,来更严格地定义EV亚群。有趣的是,研究发现具有双阳性膜蛋白的EV亚群在癌症诊断、预后预测和治疗反应监测方面具有广阔的前景。
选择合适的分离技术是进一步深入研究EVs生物学功能及其下游分析的重要基础。现有的EVs分离技术,包括超速离心、超滤和尺寸排阻(SEC)等,都是基于EVs的尺寸和密度等物理性质,没有选择性,这在一定程度上限制了EVs生物学功能的探索。一些研究报道,抗体和适配体修饰的磁珠或新材料可以提供反应界面,可以实现特异蛋白阳性EVs亚群的分离。然而,它们都是基于单一阳性参数,不可避免地会受到可溶性游离蛋白、脂蛋白和EVs碎片的影响。因此,实现EV特异亚群的多参数分离和富集仍然具有一定的挑战性。
近日,南方医科大学南方医院郑磊教授与李博副教授课题组在Advanced Healthcare Materials杂志上发表了题为“Isolation and enrichment of extracellular vesicles with double-positive membrane protein for subsequent biological studies”的学术论文(2023 Nov 9:e2303430),报道了一种基于邻位连接(Proximity Ligation Assay, PLA)的膜蛋白双阳性EVs分离富集新技术,并在下游EVs生物学功能探索、标志物筛选和癌症诊断方面进行了初步应用。
邻位连接(PLA)是通过构建一对抗体-DNA偶联物,将蛋白质信息转化为核酸检测信号的一种特殊的免疫分析方法。当两种抗体-DNA偶联物识别同一靶蛋白的不同表位时,核酸探针之间的距离非常接近,产生所谓的接近效应,被广泛地应用于血液和其他体液中微量蛋白的检测。在这项工作中,作者以PLA为技术核心,通过两个抗体核酸复合物特异性的靶向EVs膜蛋白标志物,再引入连接两个抗体核酸复合物的RNA链形成DNA-RNA复合体,实现EVs双阳性膜蛋白的捆绑,然后通过偶联了DNA-RNA复合体抗体的免疫磁珠特异性地捕获DNA-RNA复合体实现膜蛋白双阳性EVs亚群的分离,最后通过酶切核酸链实现膜蛋白双阳EVs亚群的富集(图1)。
研究发现,该方法的捕获效率可达到约83.87%,每个磁珠平均可提供约1425个EVs捕获位点,有利于膜蛋白双阳行EVs亚群的大规模分离富集。此外,该方法在一定程度上避免了可溶性蛋白的干扰,具有良好的特异性(图2)。为进一步探究膜蛋白双阳性EVs亚群的生物学功能,研究者分离富集的特异EVs亚群可进一步被用于细胞摄取研究、高通量小RNA测序和乳腺癌诊断。总的来说,膜蛋白双阳性细胞外囊泡的分离富集技术为特定EVs亚群的分离富集及后续促进EVs基础和临床研究的发展提供了新的研究策略。
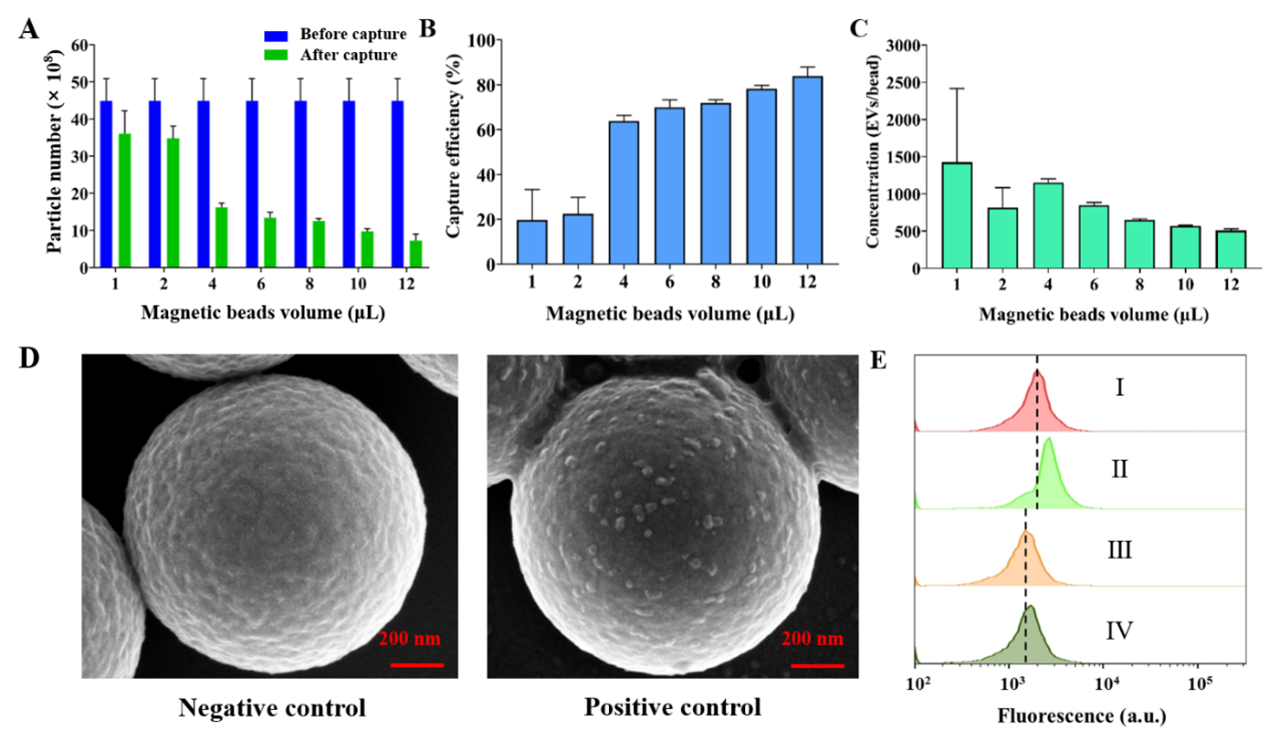 图2:膜蛋白双阳性细胞外囊泡的分离富集技术性能评价
图2:膜蛋白双阳性细胞外囊泡的分离富集技术性能评价
南方医科大学南方医院郑磊教授和李博副教授为论文的共同通讯作者。南方医科大学南方医院刘春辰博士、林慧娴博士和于海洋硕士为论文的共同第一作者。
参考文献:
Isolation and enrichment of extracellular vesicles with double-positive membrane protein for subsequent biological studies, Adv. Healthc. Mater. 2023 Nov 9:e2303430. doi: 10.1002/adhm.202303430.
外泌体资讯网 Advanced Healthcare Materials:膜蛋白双阳性细胞外囊泡的分离富集及其后续生物学研究