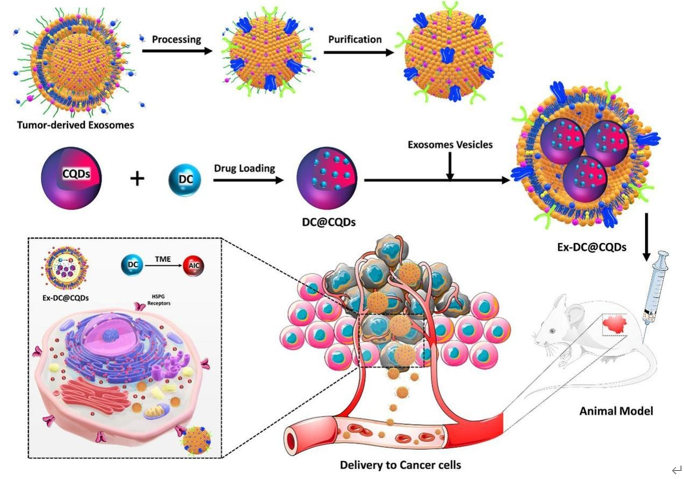
在乳腺癌治疗中,化疗药物的不精确靶向往往导致严重的毒性。近日,一项来自印度科学家的最新的研究为乳腺癌治疗带来了一种创新的策略,提出了一种针对性输送化疗药物的新型外泌体系统,有望显著提高治疗效果并减少对正常细胞的不良影响。他们利用碳量子点(CQDs)实现针对乳腺癌细胞的化疗药物达卡巴嗪(DC)的包装,随后用乳腺癌细胞衍生的外泌体包被(Ex-DC@CQDs),实现了治疗的精准靶向。相关内容以“Dacarbazine-primed carbon quantum dots coated with breast cancer cell-derived exosomes for improved breast cancer therapy”为题在线发表于11月19日的国际综合学术期刊Journal of Controlled Release上。
乳腺癌是一个全球女性中严重的健康问题。尽管传统疗法取得了进展,但临床毒性和靶向不准确仍然困扰着乳腺癌治疗。纳米医学引入了外泌体(Exo)作为一种有前途的治疗选择。这些小囊泡(30-150纳米)由各种细胞分泌,包括癌细胞。癌细胞源性的外泌体能够靶向肿瘤,促进组织修复,并调节免疫系统。这些外泌体相对于其他药物传递方法具有多个优势,如更高的生物利用度,增强的稳定性,以及较低的非靶向细胞毒性和免疫原性。这种传递机制的选择性质减少了对健康细胞的非特异性摄取,从而降低了毒性和不良反应的风险。然而,成功开发基于外泌体的药物传递系统需要解决关键问题,如体内分布、药代动力学和复杂的运输与通信机制。
乳腺癌细胞依赖于岩藻糖这一类型的糖来进行生长,使它们对其比正常细胞更为依赖。这种对岩藻糖的依赖性为有针对性的治疗干预提供了机会。碳量子点(CQDs)已经成为一个有前途的传递平台,可以有选择地靶向和治疗各种癌症,包括乳腺癌。基于岩藻糖的CQDs具有生物降解性、生物相容性、在水介质中的分散性,以及抗氧化和抗癌特性。它们可以有效地将治疗荷载输送到乳腺癌细胞,同时通过产生活性氧化物质(ROS)表现出固有的抗癌活性。然而,它们对各种细胞类型均具有结合亲和力,不仅限于癌细胞,在健康细胞上也会结合。此外,QDs的大小异质性影响了它们在细胞摄取动力学中的作用,较大的QDs在穿透细胞方面面临挑战,而较小的QDs则表现出更高的细胞进入可能性,潜在地导致损害。如果能够解决基于岩藻糖的QDs的这些挑战,在乳腺癌治疗中将更加有靶向药物输送的潜力。
达卡巴嗪(Dacarbazine,DC)是一种化疗前药,通过多方面的作用方式发挥其抗癌效果。DC在肝脏中代谢激活,形成与癌细胞中的DNA分子共价结合的反应性代谢物。这种共价结合导致DNA链的交联,破坏核酸结构,引起细胞在细胞分裂的各个阶段的死亡。尽管DC在某些癌症如霍奇金淋巴瘤和转移性黑色素瘤中显示出疗效,但其在乳腺癌中的机制和治疗潜力仍未被充分探索。DC在乳腺癌治疗中的应用面临的挑战主要来自其溶解度差、容易光降解和生物半衰期短。这些限制可能影响药物分布、生物利用度和治疗效果,并可能导致对健康细胞的非特异性细胞毒性和不良副作用。
在这项研究中,研究人员制定了一种使用碳量子点实现化疗药物DC对乳腺癌细胞的有针对性输送策略。DC被加载到CQDs上,以提高其溶解性和光稳定性,然后被封装在源自乳腺癌细胞的外泌体内(Ex-DC@CQDs),以实现治疗的有针对性。纳米颗粒跟踪分析和免疫印迹显示Ex-DC@CQDs保留了外泌体的结构和功能特性。
研究结果发现,外泌体通过肝素硫酸酰基蛋白聚糖(HSPG)受体促进了DC@CQDs对癌细胞的转运,随后导致线粒体膜电位的增加、ROS生成和诱导细胞凋亡,最终导致细胞死亡。外泌体通过HSPG受体选择性地靶向癌细胞,并保护DC和CQDs的完整性。外泌体通过与细胞膜融合并促进DC在癌细胞内特异性激活,加速了DC@CQDs传递到癌细胞的过程。由乳腺癌细胞释放的外泌体含有特定蛋白质(肝素酶、syndecan-1和glypican-1),它们与HSPG受体结合。外泌体与HSPG受体之间的相互作用触发了由内吞作用介导的内部化过程。这使得外泌体有效地将外泌体载体,包括药物、蛋白质和核酸,传递到目标细胞,确保了有针对性的治疗方法。
体内成像和药代动力学研究表明,与游离DC相比,Ex-DC@CQDs显示出增强的抗肿瘤靶向和疗效,这是由于通过外泌体介导的HSPG受体驱动的细胞摄取实现更大的肿瘤积累,以及Ex-DC@CQDs的持续释放。更为重要的是,外泌体还具有天生表达重要细胞色素酶的能力,这将在外泌体通过HSPG介导的空间靶向进入肿瘤微环境后,直接促进DC的激活,从而提高了治疗效果,同时减少了对正常细胞的不良影响。
这一新型外泌体药物输送系统将大幅改善乳腺癌治疗的效果,并且能够避免单独使用DC所伴随的许多风险。此外,外泌体天生具有穿越生物屏障的内在能力,有望弥补药物在循环过程中丢失的问题。这项技术的成功应用为乳腺癌治疗带来了新的希望,这种新型外泌体药物输送系统有望成为精准治疗乳腺癌的有力工具。Ex-DC@CQDs作为一种创新的治疗方式,展现出了巨大的潜力,并为未来乳腺癌治疗的发展打开了新的局面。
参考文献:Dacarbazine-primed carbon quantum dots coated with breast cancer cell-derived exosomes for improved breast cancer therapy. J Control Release. 2023 Nov 5: S0168-3659(23)00722-8.