胰导管腺癌占胰腺癌的90%以上,是最具有侵略性的恶性肿瘤之一,其5年生存率仅为8%-9%。根据美国癌症协会的癌症统计数据,美国在2022年确诊的胰导管腺癌新病例超过55989例(男性29673例,女性26316例)。大多数患者未能在胰导管腺癌的早期阶段得到诊断,造成了大约48,220人的死亡。尽管有各种因素影响癌症患者的治疗结果,但仍然存在两个基本问题,即可靠的胰导管腺癌诊断/预测方法和有效的治疗方案。目前胰导管腺癌诊断/预测方法不佳的原因是多方面的,包括早期的胰导管腺癌表现出非特异性症状甚至没有症状,缺乏敏感和特异性的生物标志物,以及早期肿瘤成像困难等。而胰导管腺癌治疗失败原因通常是其发病隐匿、高侵袭性和癌细胞转移等造成的。因此,早期诊断和有效的治疗策略是提高胰导管腺癌治疗效果的关键。癌细胞来源的外泌体携带了各种生物信息和生物大分子(如RNAs、DNAs、蛋白质、脂质和糖类),构成了癌细胞的关键特征(如遗传和表型状态),是极具竞争力的非侵入性癌症诊断的生物标志物。此外,基于癌细胞来源的外泌体的形成和分子功能的新见解,也为其用于癌症的新型治疗策略铺平了道路。
近日,麦考瑞大学王玉玲副教授团队以及南开大学刘定斌教授在Journal of Nanobiotechnology(中科院1区,IF=9.429)杂志上发表题为“Cancer-derived small extracellular vesicles: emerging biomarkers and therapies for pancreatic ductal adenocarcinoma diagnosis/prognosis and treatment”的综述(doi: 10.1186/s12951-022-01641-0),全面总结了癌症来源外泌体在胰导管腺癌诊断/预测和治疗策略方面最新的研究进展,并讨论了目前面临的困境以及进一步临床应用的前景,为后续相关研究提供思路。
外泌体的生物生成促使复杂的细胞外和细胞内分子以特定的方式装载到外泌体中(或外泌体表面)。因此,胰导管腺癌来源的外泌体可以提供肿瘤相关的遗传和表型状态的生物信息。这些生物信息能够用于区别癌症细胞来源的外泌体与健康细胞来源的外泌体。这些外泌体很容易从体液(如血液)中收集。在外泌体内源性膜的保护下,这些外泌体携带的生物分子可以在血液循环中保持稳定,这使得癌症的诊断/预测更加可靠。血液中的的外泌体可以通过不同的分离方法(如超速离心法、免疫亲和分离法、聚合沉淀分离法和尺寸排除色谱法)富集,其分子成分(如RNAs、DNAs、蛋白质、脂质和糖类)可以通过相应的技术(如聚合酶链反应、凝胶电泳、流式细胞仪和质谱分析)进行分析,用于癌症诊断/预测。这篇综述对外泌体中RNAs、DNAs、蛋白质、脂质和糖类在胰导管腺癌的诊断/预测进行了总结。
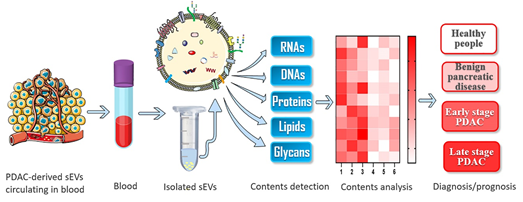
图1:癌细胞来源外泌体相关生物分子分析用于胰导管腺癌诊断/预测
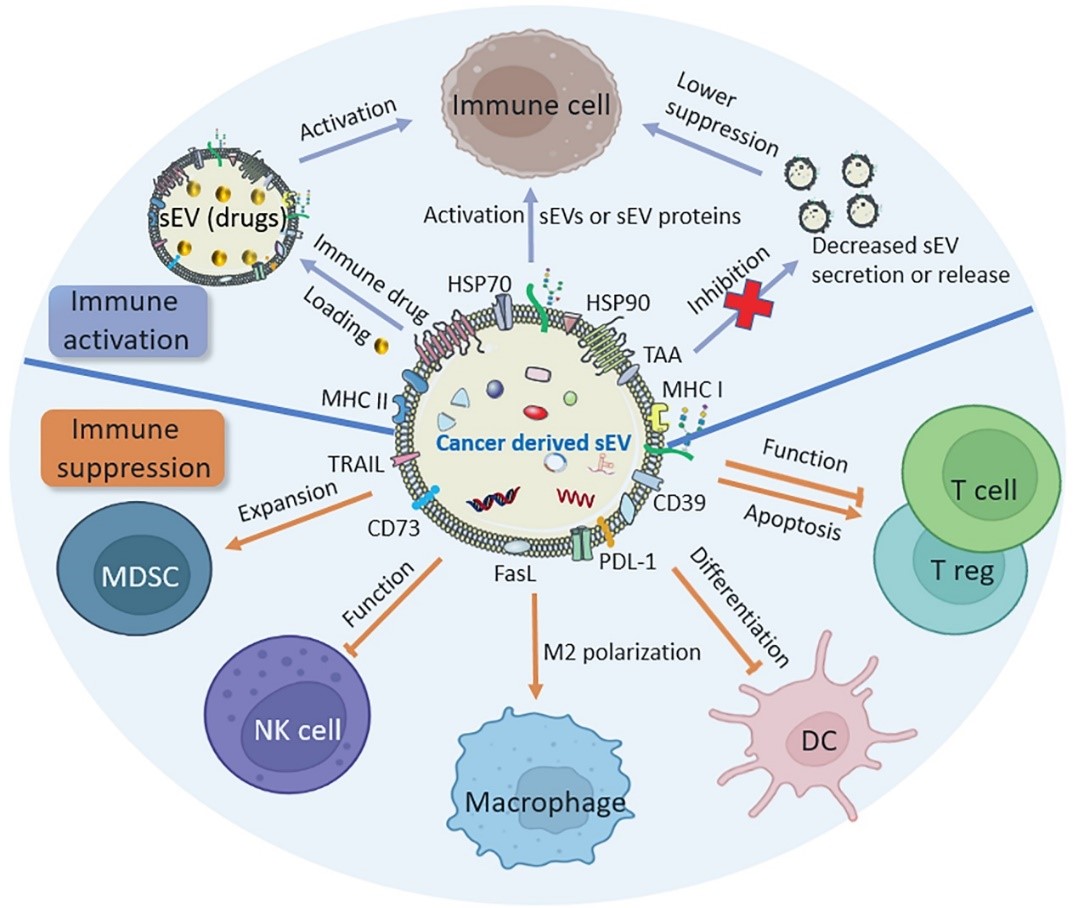
由于癌细胞来源的外泌体的内源性分子可能会促进癌症的转移,因此对癌细胞来源的外泌体在治疗方面的探索仍处于起步阶段。在过去几年中,研究人员已经开发三种基于癌细胞来源的外泌体的治疗方法,包括抑制癌细胞来源的外泌体的形成或分泌,将癌细胞来源的外泌体作为潜在的药物载体用于靶向治疗和以及用于免疫治疗。与其他治疗策略相比,基于癌细胞来源的外泌体治疗方法可能具有靶向性、高稳定性、跨生物屏障能力和低毒副作用等特点。这篇综述对基于癌细胞来源的外泌体相关治疗策略在癌症治疗中的原理及其在胰导管腺癌治疗中的最新研究进行了总结。
图2:癌细胞来源外泌体对免疫细胞的作用以及用于癌症免疫治疗的策略参考文献:Cancer-derived small extracellular vesicles: emerging biomarkers and therapies for pancreatic ductal adenocarcinoma diagnosis/prognosis and treatment, J Nanobiotechnology. 2022 Oct 14;20(1):446. doi: 10.1186/s12951-022-01641-0.
外泌体资讯网 J Nanobiotechnology | 麦考瑞大学王玉玲联合南开大学刘定斌教授团队:癌源性小细胞外囊泡:新生的胰腺导管腺癌诊断/预后和治疗标记物