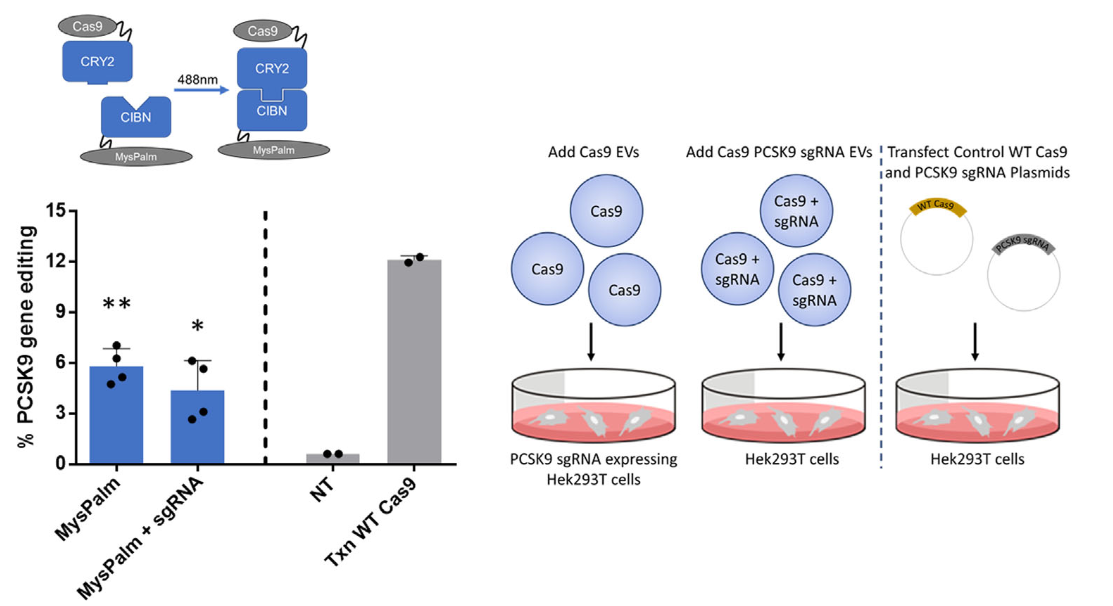
细胞外囊泡 (EV) 作为生物运载工具,在治疗应用中需要有效的货物装载,这也是目前EV研究的瓶颈之一。近日,来自阿斯利康公司的生物制药研发部门的研究人员将EV分选的伙伴蛋白与Cas9融合进行可逆的异源二聚化,将CRISPR/Cas9包装到EV中,实现目标基因的精确编辑和疾病治疗。该研究发表于J ExtracellVesicles杂志上。成簇的规则间隔短回文重复序列 (CRISPR) 相关的核酸内切酶 9 (Cas9) 被用于精确的基因编辑,为遗传疾病的治疗带来巨大希望。CRISPR/Cas9治疗应用的主要挑战之一是将Cas9 蛋白及其相关机制安全、有效和有针对性地递送至患病细胞。特别是,化脓性链球菌来源的Cas9的尺寸较大(4113个核苷酸/1371个氨基酸),这超过了常规AAV病毒载体递送能力。使用基于病毒和脂质纳米颗粒的递送载体对CRISPR/Cas9治疗递送的研究工作正在推进,但仍需要开发安全和更有效的递送方法。细胞外囊泡 (EV),包括外泌体、微泡以及其他亚型,是几乎所有细胞类型释放的纳米级颗粒,并参与细胞间功能活性蛋白质、脂质和核酸的转移。EV在与癌症、心血管和神经退行性疾病相关的许多生理和病理过程中发挥着重要作用。治疗性货物可以与纯化的囊泡共孵育,被动包装到颗粒中,或通过使用电穿孔、冻融、超声处理、挤压等技术对脂质双层进行瞬时物理破坏来包装到EV中。或者,可以对生产细胞进行基因工程以释放已经携带治疗货物的EV。这种方法实现了治疗应用EV的大规模生产。但是,如果不进行主动的EV 编辑,则包装到EV中的货物通常仅限于较小的蛋白质和较短的RNA。将大型蛋白质货物的包装到EV中仍然具有挑战性。为了克服将大蛋白质装载到EV中的挑战,研究人员探索了各种蛋白质异源二聚体技术,以将货物可逆地固定到EV中。异源二聚体的伙伴蛋白之一作为货物与Cas9 融合。另一个伙伴蛋白融合到EV富集的蛋白质(例如四次跨膜蛋白),或用脂肪酸部分修饰,这被称为 EV分选基序。这导致膜定位和这些修饰蛋白优先掺入EV中。控制蛋白质异源二聚体进入 EV的装载系统包括EV生产的主动装载和受体细胞中的货物释放,以允许Cas9货物自由运输到细胞核。这些系统包含三个光诱导系统和一个小分子诱导系统,如下:用于光诱导蛋白质二聚化的最广泛使用的系统之一是隐花色素2 (CRY2) 及其相互作用的蛋白质CIBN。CIBN和CRY2需要暴露于蓝光(450–488 nm) 以在黄素腺嘌呤二核苷酸 (FAD) 生色团作为光吸收生色团存在的情况下进行二聚化。有趣的是,CIBN-CRY2系统已成功用于将Cre重组酶和NF-κB通路抑制因子srIκB包装到EV中。光敏色素B (PHYB) 及其相互作用蛋白PIF6需要630 nm光和藻蓝胆素 (PCB) 的存在才能进行异源二聚化。这种方法的一个缺点是光吸收发色团PCB不存在于哺乳动物中,需要外源添加才能使系统正常工作。或者,可以通过引入参与从血红素合成PCB的细菌基因将生物合成途径引入哺乳动物细胞,这是本研究中应用的方法。基于Vivid的磁性异源二聚化是通过电荷匹配的工程化VVD蛋白实现的,其中一个异二聚体伴侣蛋白被设计为在其表面显示正电荷,另一个携带负电荷,在正常的暴露于蓝光 (470 nm) 时形成 VVD的低聚物。最后,研究人员探索了一种小分子诱导的二聚化系统。该系统由FKBP蛋白及其相互作用蛋白FRB组成。两个蛋白质结构域在存在rapalog二聚配体的情况下发生异源二聚化。在这项研究中,研究人员开发并比较了上述几种蛋白质异源二聚化系统将Cas9装载到EV中的效率,并评估了Cas9向靶细胞的转移能力。使用标准方法从工程化的Expi293F细胞中收集装载Cas9的EV,使用纳米粒子跟踪分析、蛋白质印迹和透射电子显微镜进行表征,并利用Cre-Lox荧光报告基因系统分析CRISPR/Cas9介导的功能基因编辑。经过筛选,研究人员发现,使用隐花色素CRY2与CD9结合或与肉豆蔻酰-棕榈酰-棕榈酰化脂质结合的光诱导二聚化,实现每个EV约25个Cas9分子的有效包装和高功能递送,在HEK293和HepG2 细胞分别实现了51%和25%的Cre报告基因编辑。这种方法对于靶向敲除治疗相关的PCSK9基因也是有效的,在HEK293中具有6%的插入缺失效率。Cas9的传递对去污剂敏感,并与EV组分相关。考虑到EV相对于其他传递载体的优势,这项研究将提升CRISPR/Cas9介导的基因组编辑在疾病治疗中的应用前景。参考文献:Engineered Cas9 extracellular vesiclesas a novel gene editing tool. J Extracell Vesicles. 2022 May;11(5):e12225.外泌体资讯网 JEV丨细胞外囊泡运载工程化Cas9作为一种新型基因编辑工具