特发性肺纤维化(IPF)是一种不可逆且致命的肺部疾病,其特征是肺泡上皮细胞持续损伤和细胞外基质沉积。当前FDA批准的药物如尼达尼布和吡非尼酮仅能轻微减缓疾病进展,无法显著延长中位生存期,且伴随严重的副作用。因此,迫切需要开发新型治疗策略。间充质干细胞来源的细胞外囊泡(MSC-EVs)因其抗炎和组织修复等特性,在肺纤维化治疗中展现出巨大潜力,但其应用仍面临多重挑战,如产量低、高度异质和肺部递送效率低下等。
中国科学院宁波材料所王凯喆、宁波市第二医院董昭兴教授和上海大学李江教授合作团队,基于上述问题开发了一种仿生细胞外囊泡球形核酸(BEV-SNA)平台,用于治疗肺纤维化。该研究以“Lung-Penetrating Biomimetic Extracellular Vesicle Spherical Nucleic Acids for Pulmonary Fibrosis Therapy Through ROS Scavenging and Anti-Inflammatory Effects”为题,发表于 Aggregate 期刊(IF=13.9,中科院1区TOP)上。
通过将原代间充质干细胞(MSCs)机械挤压得到的仿生细胞外囊泡(BEVs)与胆固醇修饰的单链DNA(chol-ssDNA)通过疏水共组装,获得具有三维伸展结构的BEV-SNA。在保持干细胞特性的P0-P1代MSCs中,BEVs的产量较天然EVs增加了17.2倍。较裸的BEVs,BEV-SNA显示出更强的ROS清除能力,可以减轻肺部的氧化应激损伤。得益于其三维致密且带负电的DNA壳层,BEV-SNA能够减少气道粘液吸附,实现肺组织深部递送,并在肺泡上皮细胞中高效摄取。在IPF模型中,BEV-SNA展现出多阶段的治疗效果,包括保护肺泡上皮细胞免受ROS损伤、抑制炎症以及晚期的抗纤维化作用,有效阻止纤维化进展,实现了50%的存活率。这项研究具有以下显著优势:
(1)高生物活性。天然细胞外囊泡(EVs)虽具有优异的组织修复和免疫调节特性,但通常需对干细胞进行长期传代扩增以获得足量EVs,此过程易导致干细胞特性丢失及批次差异性。该研究直接从有限数量的P0-P1代原MSCs制备仿生细胞外囊泡(BEVs),规避了长期传代带来的挑战,有效维持了干细胞效能,保障了生物活性的稳定性和高效性。
(2)高效肺部递送。肺部给药常受气道屏障阻碍,递送载体易被呼吸道黏液捕获而降低穿透能力。得益于BEV-SNA表面密集的三维寡核苷酸层,其强负电荷表面特性显著减少气道吸附,实现深部肺组织渗透。此外,球形核酸结构大幅提升了肺上皮细胞的胞内摄取效率。
(3)ROS清除与抗炎协同作用。BEV-SNAs通过协同机制同时针对 ROS-炎症-纤维化轴。具有氧化还原活性的DNA冠层和BEVs核心可有效清除ROS,同时减轻炎症反应,从而阻断 ROS-炎症自我放大循环。此外,BEVs内源性成分还能促进成纤维细胞失活和细胞外基质重塑。这些多功能作用可保护肺上皮细胞免受损伤,抑制病理纤维化进展,改善肺组织恢复。
该研究提出了一种结合BEVs的自然仿生特性与SNAs的功能适应性的新型治疗平台,为肺部药物递送和呼吸系统疾病治疗提供了一种创新策略。
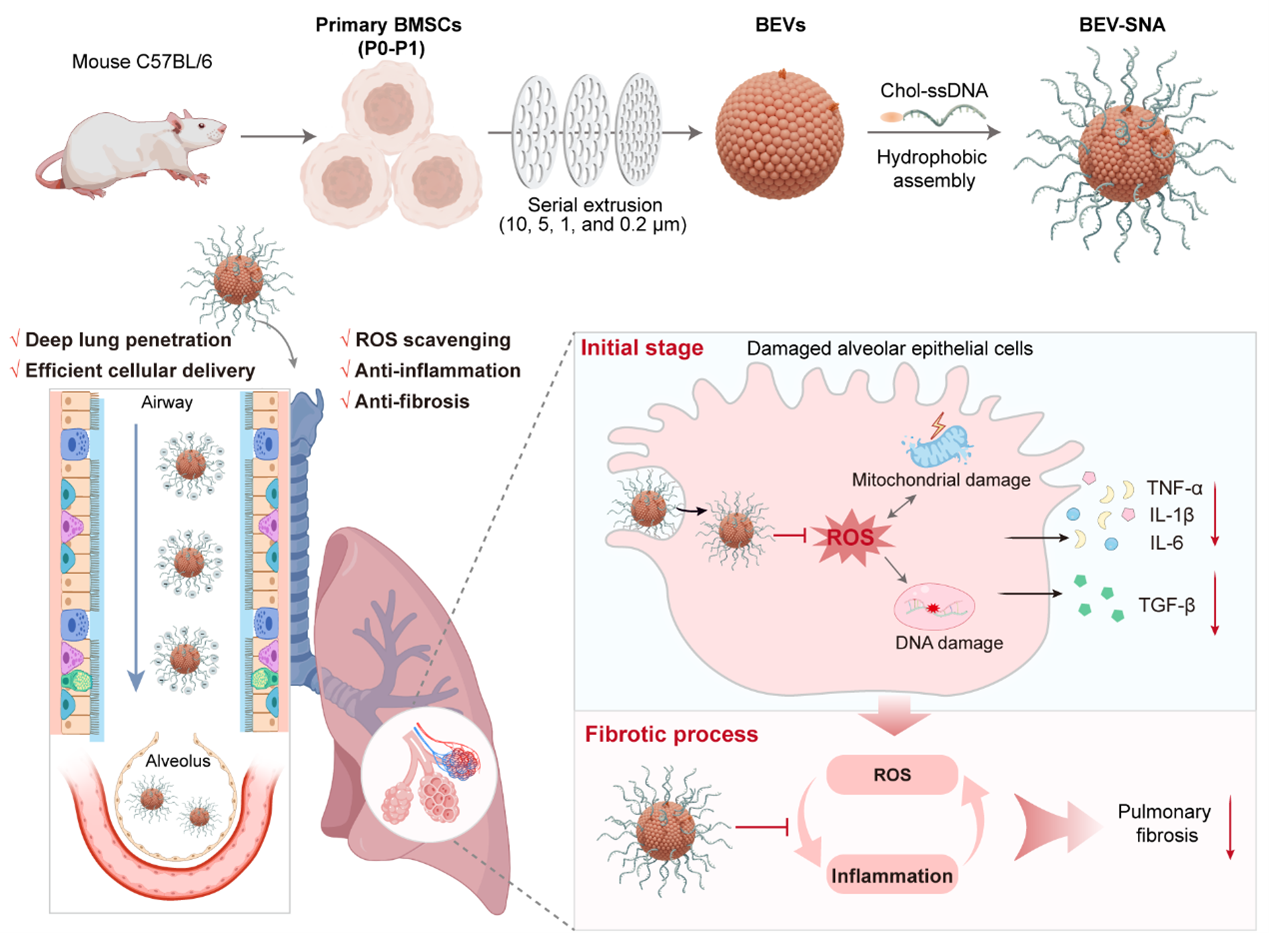
图1. 仿生细胞外囊泡球形核酸(BEV-SNA)深入肺部递送治疗肺纤维化示意图
参考文献:
Lung-Penetrating Biomimetic Extracellular Vesicle Spherical Nucleic Acids for Pulmonary Fibrosis Therapy Through ROS Scavenging and Anti-Inflammatory Effects. Aggregatee70086. https://doi.org/10.1002/agt2.70086
外泌体资讯网 Aggregate |中国科学院宁波材料所 王凯喆团队:仿生细胞外囊泡球形核酸深入肺部递送用于肺纤维化治疗





