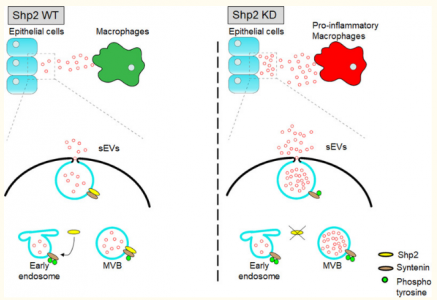
由内体来源的小细胞外囊泡(主要是外泌体)的生物发生过程通常受到严格的调控。但是相比于功能报道,小细胞外囊泡的发生过程研究要少得多。蛋白激酶在生物过程中发挥着重要而又精细的调节作用,但是蛋白磷酸酶的研究报道则要少一些。目前,蛋白磷酸酶在细胞外囊泡的形成和释放调控中的报道还很少见。近日,浙江大学医学院柯越海、张雪研究组揭示了蛋白磷酸酶Shp2在内体来源的小细胞外囊泡发生调控中的功能作用。这一研究报道丰富了我们对小细胞外囊泡形成调控的认识。相关研究成果以“Phosphatase Shp2 regulates biogenesis of smallextracellular vesicles by dephosphorylating Syntenin”为题,发表在Journal of Extracellular Vesicles上。 由多泡小体(MVB)的胞吐作用分泌的小细胞外囊泡(sEVs)是存在于各种体液和间质液中的纳米级囊泡(直径通常小于200 nm)。 sEV能够充当包含蛋白质,脂质,DNA和mRNA的载体来介导细胞间通讯。 sEV形成的精确调控在细胞间通讯中起着至关重要的作用。sEV的产生源自内体途径。 MVB是由早期内体的内陷导致腔内小泡(ILV)积累形成的。然后,MVB与质膜融合,并将ILV释放到胞外空间。 sEV充当细胞间通信的信使,并进一步影响受体细胞的信号传导途径,从而调节其功能。近年来,尽管对细胞外囊泡的研究越来越多,但调节细胞外囊泡生产的分子机制仍不清楚。许多蛋白复合物参与了MVBs中ILV的形成(即sEVs的生物发生机理)。这些机制主要包括ESCRT依赖性途径和ESCRT非依赖性途径。此外,这两种途径并非相互独立,因为两个途径中都存在MVB到sEV的形成过程。它们是协同工作来产生不同的sEV亚群。Syntenin-Syndecan-ALIX在sEV的生物发生中起关键作用。 Syntenin–Syndecan复合物通过ALIX与ESCRT蛋白复合体相连,从而导致MVB处的膜出芽和膜分裂。这是涉及某些ESCRT组件的中间路线。 Syndecan是能够与硫酸乙酰肝素相互作用的蛋白,它广泛存在于细胞表面和sEV中。 Syndecan通过特定的衔接蛋白Syntenin包装到sEV中。同时,Syntenin与ALIX相互作用,将由Syndecan介导的货物分类为sEV。此外,乙酰肝素酶影响Syndecan–Syntenin–ALIX调节的sEV产生。乙酰肝素酶对sEV形成的影响取决于Syntenin与ALIX之间的相互作用。作为已知的调节剂,小的GTPase ADP核糖基化因子6(ARF6)及其效应磷脂酶D2(PLD2)通过控制ILV出芽来影响Syntenin介导的sEV的生物发生。ARF6和PLD2上游的激酶Src通过磷酸化Syntenin的酪氨酸来促进sEV生物发生。此外,Sytenin在sEV形成中的作用很复杂,需要进一步研究。作为催化蛋白质磷酸化的酶,激酶在调节各种信号通路中起着关键作用,这些信号通路广泛参与细胞功能和行为。越来越多的研究发现,各种激酶通过调节磷酸化参与sEV的生物发生。酪氨酸激酶Hck被HIV激活,并促进髓样细胞和肝细胞中含有ADAM蛋白酶的促炎性sEV的释放。丙酮酸激酶PKM2通过使SNAP-23磷酸化来增强肿瘤细胞sEV的释放。蛋白质的磷酸化受到严格的调控,并受激酶和磷酸酶的平衡作用支配。脱磷酸基团的蛋白质在去除磷酸基团后失去其先前的功能。值得注意的是,与激酶相比,磷酸酶对sEV的调节作用仍然有限。研究磷酸酶介导的去磷酸化将有助于进一步解释sEV产生的机理。 含有Src同源性2的蛋白酪氨酸磷酸酶2(Shp2)是一种在细胞质中广泛表达的非受体酪氨酸磷酸酶。它由N端的两个SH2域和C端的PTP域组成。 Shp2参与通过脱磷酸作用控制各种细胞功能和疾病过程。此外,Shp2调节肺的各种病理过程,并在肺泡微环境中起重要的调节作用。肺上皮细胞中Shp2的丢失减轻了烟雾介导的肺部炎症。嗜中性粒细胞Shp2的缺失减轻了LPS引起的急性肺损伤。到目前为止,由于有限的细胞和动物模型,我们对细胞间sEV的转移还没有足够的了解。 sEV在主要由肺上皮细胞精心安排的肺微环境的细胞间通讯中起重要作用。肺上皮细胞的反复损伤触发适应性信号通路,以维持生理稳态。肺泡巨噬细胞的功能表型由衍生自变化的微环境的相应sEVs调节。分析上皮Shp2在调节肺泡微环境中的作用将加强对肺部发病机制的了解。在本研究中,作者发现酪氨酸磷酸酶Shp2的药理抑制和shRNA介导的下调增加了体内和体外的sEV生物发生。纳米颗粒跟踪分析表明,Shp2的药理抑制作用和shRNA介导的下调增强了各种细胞中sEV的释放。在透射电子显微镜(TEM)分析的支持下,体内证据显示通过Shp2耗竭在MVB中积累了ILV。Shp2耗尽后,Syntenin的酪氨酸磷酸化会促进MVB中的ILV生成,从而显着上调EV释放量。借助Co-IP和去磷酸化测定,作者发现Shp2通过直接负调控Syntenin Y46磷酸化来影响EV的生物发生。同时,质谱(MS)和纳米级流式细胞术的数据表明Shp2稳定敲低(KD)对上皮sEV的成分和亚型并未产生任何显着变化。通过体外供体-受体sEV转移系统分析,Shp2的丢失增强了sEV介导的上皮-巨噬细胞通讯。体内上皮Shp2的丢失导致上皮sEVs增加,并导致巨噬细胞激活和肺部炎症增强。参考文献:Phosphatase Shp2 regulates biogenesisof small extracellular vesicles by dephosphorylating Syntenin外泌体资讯网 JEV:浙江大学柯越海、张雪研究组发现磷酸酶Shp2调节小细胞外囊泡的生物发生