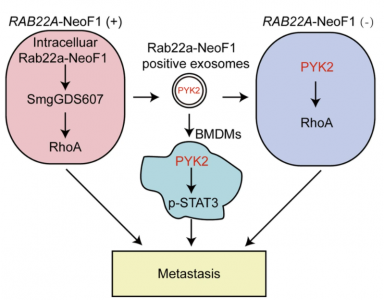
肿瘤细胞中存在着一小部分融合蛋白,它们如何影响肿瘤患者预后仍是是未知的。近日,来自中山大学肿瘤防治中心康铁邦课题组以及北京生命科学研究所隋建华课题组的研究人员发现,骨肉瘤中Rab22a-NeoF1融合蛋白及其结合伴侣PYK2通过HSP90被包装至外泌体中,外泌体Rab22a-NeoF1融合蛋白可促进骨肉瘤细胞的肺转移,因此靶向该过程有望实现转移性骨肉瘤的治疗。该研究发表于Signal Transduction and Targeted Therapy杂志上(IF13.493)。
骨肉瘤是最常见的骨骼恶性肿瘤类型之一,在青少年中发病率很高。多数骨肉瘤患者是非转移性的,通过局部手术结合新辅助多药化疗,存活率可达70%。然而仍有15–30%的患者在诊断时已经出现肺转移,因此过去30年转移性骨肉瘤的5年总生存率仍仅为20%。生长信号过度激活和高度异质性导致骨肉瘤中没有有效的分子治疗靶标。研究团队鉴定出了一种新的融合基因,称为RAB22A-NeoF1,该基因源自染色体易位,该易位是将与转运相关的Rab22a的1–38氨基酸和DOK5的反向内含子序列并列连接。研究人员此前发现,Rab22a-NeoF1融合蛋白通过与SmgGDS607的负电荷区域组成性结合而激活RhoA,从而驱动骨肉瘤的肺转移,并且可能成为骨肉瘤转移患者的潜在靶标。
细胞外囊泡(EVs)被认为是细胞间通讯的关键机制。外泌体是来源于胞内体的直径为30-150 nm的囊泡,通过明确的细胞内转运途径在多囊胞内体或多囊泡体与质膜融合的过程中释放。携带大量生物活性物质(包括脂质、蛋白质和调节性RNA)的肿瘤来源外泌体可被邻近细胞吸收或进入循环系统,并到达遥远的部位影响受体细胞的生物行为。肿瘤外泌体可以转运调节性RNA、癌蛋白以及介导免疫抑制的膜蛋白,从而促进乳腺癌和肾癌的化学耐药性,增强癌细胞活动性或促进转移前微环境形成。在生物体液中可以检测到肿瘤来源的外泌体,并作为潜在的诊断标记物,可以预测对治疗的反应。因此,研究人员推测外泌体中可能存在小比例的在癌细胞中特有的融合蛋白,这些融合蛋白可能会被周围的细胞(例如巨噬细胞和无融合基因的癌细胞)吸收,从而影响整个癌症进展,因为几十年来仍未清晰揭示融合蛋白如何影响肿瘤患者预后。
在这项研究中,研究人员发现骨肉瘤Rab22a-NeoF1融合蛋白通过其KFERQ样基序(RVLFLN)与HSP90结合而包装到外泌体中,巨噬细胞和融合基因阴性的癌细胞吸收了该蛋白。外泌体Rab22a-NeoF1融合蛋白通过募集骨髓来源的巨噬细胞促进肺转移前的微环境形成。外泌体PYK2被阴性骨肉瘤细胞吸收后激活RhoA,并在其受体巨噬细胞中诱导信号转导子和转录激活因子3的激活,从而增加M2巨噬细胞表型。外泌体Rab22a- NeoF1融合蛋白可通过其供体细胞的结合伴侣PYK2激活RhoA来促进其阴性受体癌细胞的肺转移。因此,该外泌体Rab22a-NeoF1融合蛋白促进了其受体骨肉瘤细胞的肺转移,可以通过使用设计的RGD肽破坏其与PYK2的相互作用来靶向该过程,实现肺转移的抑制作用。
参考文献:Rab22a-NeoF1 fusion protein promotes osteosarcoma lung metastasis through its secretion into exosomes. Signal Transduct Target Ther. 2021 Feb 11;6(1):59.