胰高血糖素样肽-2(GLP-2)是短肠综合征(SBS)肠道康复治疗的关键因素。来自南京大学医学院附属金陵医院黎介寿教授课题组的研究人员在Theranostics杂志上发表文章,发现GLP-2通过下调GLP-2R受体阳性的肠成肌纤维细胞分泌的外泌体miR-125a/b,调节肠上皮细胞的增殖和凋亡,在SBS肠切除后促进了肠道功能的恢复。
短肠综合征(SBS)是一种主要表现为严重的吸收不良、营养不良、腹泻和电解质紊乱的疾病,这种疾病通常由于局部缺血、克罗恩病,裂腹畸形、肠道闭锁或创伤引起的大规模小肠切除引起的。SBS是儿童和成人中慢性肠功能衰竭(CIF)的最常见原因。一旦SBS患者无法通过肠道康复治疗恢复肠道自主性,则患者将发生不可逆发生CIF,并且需要终生的肠外营养补充(PN)支持,这将给家庭和社会带来沉重的经济负担。更糟糕的是,长期使用PN可能导致危及生命的并发症,例如败血症和慢性肝病。SBS的外科治疗,例如外科手术重建和小肠移植,发病率和死亡率也很高。在这种情况下,旨在最大化剩余小肠吸收能力,并让SBS患者自己脱离PN的肠康复治疗已成为SBS治疗的重点和突破点。
胰高血糖素样肽-2(GLP-2)是回肠远端和结肠近端L细胞分泌的肠道营养生长因子,但其生物学活性主要在近端小肠中起作用。GLP-2是一种33个氨基酸的肽,在目前的SBS治疗中作为治疗重点。GLP-2可诱导肠隐窝细胞增殖,抑制肠细胞凋亡,促进肠绒毛增殖,从而促进肠粘膜扩张和营养吸收。GLP-2通过7次跨膜G蛋白偶联的GLP-2R受体发挥其功能,并且GLP-2R的表达主要限于胃肠道,在空肠中最高。研究表明,肠隐窝上皮细胞和肠绒毛上皮细胞不表达GLP-2R,而肠间质细胞(如肠上皮下成肌纤维细胞,ISEMFs)则表达GLP-2R。先前的研究表明,GLP-2的生物学作用可能是通过肠上皮细胞与GLP-2R阳性细胞之间的细胞间通讯来实现的。尽管如此,潜在的机制仍然不清楚。
具有脂质双层结构的外泌体是大多数细胞释放的30-150 nm囊泡,并且富含功能成分,例如miRNA和蛋白质。miRNA已被认为是外泌体的关键组成部分,并在很大程度上决定了外泌体对细胞通讯的影响。多项研究表明,许多miRNA参与了肠道上皮细胞的增殖、分化和凋亡,例如miR-30、miR-33、miR-22、miR-25和miR-145。鉴于miRNA参与了许多生理和病理过程,很可能也参与了肠上皮细胞和GLP-2R阳性细胞之间的细胞间通讯,但很少有研究miRNA负载的外泌体对肠上皮细胞增殖和凋亡的调节作用。载有miRNA的外泌体是否可作为由GLP-2R阳性肠成肌纤维细胞调控的下游旁分泌信号,需要进一步探索。
在这项研究中,研究人员确认了肠道微环境中外泌体miR-125a/b参与GLP-2介导的肠上皮细胞-成纤维细胞的通信。研究人员使用超速离心方法从GLP-2或对照组处理的SBS大鼠的残余空肠组织里提取外泌体,并通过纳米颗粒追踪分析(NTA)、透射电子显微镜和Western blot进行鉴定。miRNA测序与qRT-PCR验证相结合,鉴定了差异表达的miRNA,筛选了可能参与肠道上皮细胞增殖和凋亡的miRNA,并通过miRNA功能实验进一步验证。结果显示,GLP-2可显著促进II型SBS大鼠肠道小肠隐窝上皮细胞的增殖,并抑制其肠绒毛上皮细胞的凋亡。在残余空肠组织来源的外泌体和GLP-2R阳性细胞分泌的外泌体中,GLP-2均可以显著下调外泌体miR-125a/b。外泌体miR-125a/b促进了GLP-2介导的肠上皮细胞增殖,并降低凋亡。miR-125a/b通过抑制MCL1抑制肠上皮细胞的增殖并促进其凋亡。
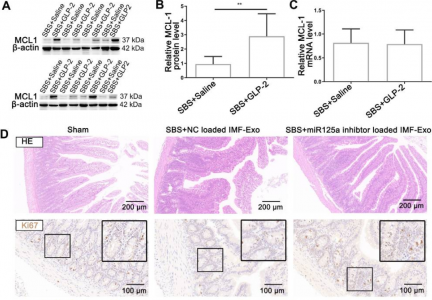
图:GLP-2通过降低外泌体miR-125a/b,从而在体内上调MCL1表达来发挥其营养肠道的作用。
该研究发现,肠道成纤维细胞衍生的外泌体的miR-125a/b调节肠道上皮细胞的增殖和凋亡。GLP-2处理可显著降低肠道成肌纤维细胞外泌体中miR-125a/b的水平。miR-125a/b通过靶向MCL1的3'UTR区域来调节肠道上皮细胞的增殖和凋亡。因此,这项研究阐明了肠道微环境中细胞之间遗传物质交换的新机制。




