COVID-19大流行对全球公共卫生构成了前所未有的威胁。近日,解放军总医院第五医学中心王福生院士和张纪元副研究员、中国科学院遗传与发育生物学研究所税光厚研究员团队合作在Cell Metabolism杂志上发表文章,展示了轻度、中度和重度COVID-19患者和健康对照组的血浆脂质组和代谢组,并证明严重程度越高的COVID-19患者的外泌体中单唾液酸二己糖神经节苷脂(GM3)含量的升高。
新型冠状病毒疾病(COVID-19)目前在全球大流行中,是由严重急性呼吸综合征冠状病毒2(SARS-CoV-2)引起的,该病毒以血管紧张素转化酶2(ACE2)为宿主进入受体细胞。ACE2高表达的II型肺泡上皮细胞是SARS-CoV-2的靶标。大多数COVID-19病例表现出轻度至中度症状,但一些肺炎患者恶化为严重的呼吸衰竭,需要插管和机械通气。
众所周知,病毒会引起宿主细胞脂质组的变化,并在其利用宿主代谢资源的过程中篡夺关键的能量途径,为病毒感染的不同阶段提供物质和能量。很多研究已经报道了不同病毒感染的血浆或血清脂质组与疾病相关的变化。例如,在寨卡病毒感染的患者中观察到血清缩醛磷脂酰乙醇胺(PEps)的增加。在呼吸道合胞病毒(RSV)感染的小鼠中,血浆三酰甘油(TAGs)和游离脂肪酸(FFA)减少,并且许多PEps和缩醛磷脂酰胆碱(PCps)升高。对于针对呼吸道和肺的病毒感染,急性呼吸窘迫综合征(ARDS)的发展也可能改变与炎症过程有关的脂质。例如,与存活者相比,ARDS的非存活者血浆中多不饱和磷脂酰胆碱(PUFA-PCs)、PUFA-PE和PUFA-TAGs减少,血清C18-FFA升高与ARDS发展相关。
唾液酸通常在细胞分泌物中和在细胞外表面上作为连接到糖蛋白和糖脂(即神经节苷脂)的末端基序。据报道,唾液酸化可以介导许多病毒的结合和传播。唾液酸化表现出关于细胞间通讯的双重性质,介导病毒结合和识别,或充当通过屏蔽细胞抗原位点抑制免疫反应性的“面具”。唾液酸化的效果取决于连接至唾液酸部分的特定取代基。除了在与宿主细胞结合中改变特定脂质外,病毒还可能改变宿主的内源性过程,以实现细胞间传播。例如,丙型肝炎病毒(HCV)和人免疫缺陷病毒(HIV)的细胞外释放与多囊泡体(MVB/晚期内体有关。MVB的逆行运动以及随后与质膜的融合将捕获的病毒颗粒释放到循环系统,然后感染远处的细胞。另一方面,冠状病毒篡夺了内质网-高尔基体中间隔室(ERGIC)的运输机制,并且成熟的病毒颗粒以反高尔基网络(TGN)萌芽的运输小泡形式从被感染的细胞释放。
因此,病毒能够在细胞间传播中利用宿主来源的脂质膜来掩盖和逃避宿主的免疫系统。逃避宿主监视可以在感染的早期阶段增加病毒的复制。宿主在开始阶段未能遏制内源性传播可能会加剧疾病的严重程度和不良后果,例如淋巴细胞减少导致“细胞因子风暴”和致命性肺炎的突然发作,这是严重COVID-19病例的特征。作为SARS-CoV-2的主要靶标,肺泡II型上皮细胞合成了对调节肺功能至关重要的表面活性剂磷脂,通过内吞途径不断分泌并循环利用。从支气管肺泡灌洗液中分离出来的外泌体介导了肺泡巨噬细胞和肺泡上皮细胞之间的细胞间通讯,形成了宿主防御和抵抗空气传播病原体免疫力的屏障。因此,有必要研究循环中宿主衍生的外泌体是否与COVID-19的发病机制有关。
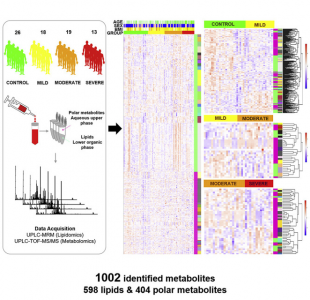
本研究中,研究人员利用靶向和非靶向串联质谱的组合,评估了76位受试者的血清脂质组和代谢物的定量血清代谢组,其中包括100种代谢物(598种脂质和404种极性小代谢物),这些受试者包括26名健康对照和50名不同严重程度(即轻度、中度和重度)的COVID-19患者。通过多尺度内嵌相关分析,研究人员提供了COVID-19发病机制的系统视角,无偏倚地揭示了病理相关的脂质组。结果显示,一组10种血浆代谢物有效地将COVID-19患者与健康对照区分开(AUC = 0.975)。COVID-19的血浆脂质组与单唾液酸二己糖神经节苷脂(GM3)富集的外泌体相似,表现为鞘磷脂(SMs)和GM3含量增加,二酰基甘油(DAGs)减少。使用从同一队列中分离的外泌体,研究人员证明了疾病严重程度较高的COVID-19患者的外泌体中富含较多的GM3。该研究工作表明,富含GM3的外泌体可能参与了与COVID-19发病机理相关的病理过程,并提供了与COVID-19不同的血浆脂质组和代谢组储存库。




