11月份国内新出的外泌体和细胞外膜泡领域论文不完全统计有119篇。IF>10的2篇,10>IF>5的27篇。本期主要内容包括:脂毒性肝细胞外泌体激活巨噬细胞引起非酒精性脂肪肝疾病、SPION-外泌体靶向胰腺给药以降低血糖、人参来源的纳米颗粒抑制黑色素瘤的生长、脂肪干细胞胞外囊泡与聚吡咯钛联合具有长期稳定性和潜在的成骨能力、通过pH响应方法分离的血液TfR+外泌体、海藻酸钠水凝胶中掺入小细胞外囊泡用于心肌梗死治疗、卵巢癌细胞外泌体miR-205诱导血管生成促进转移、自组装肽纳米纤维水凝胶、结肠癌的生物标志物、乳腺癌、肝脏外泌体、集成微流控、神经元、外泌体的聚糖、炎性肠病、直肠癌等方面内容。内容十分丰富,不容错过。相关文章的原文都在论坛同名贴下,有整理好的Endnote文献库可供下载,需要的请至外泌体之家论坛(www.exosome.com.cn)下载。
1. 上海交通大学医学院附属新华医院范建高课题组:脂毒性肝细胞分泌的外泌体miR-192-5p激活巨噬细胞引起非酒精性脂肪肝疾病
Liu, X. L., et al. (2019). "Lipotoxic Hepatocyte-Derived Exosomal miR-192-5p Activates Macrophages viaRictor/Akt/FoxO1 Signaling in NAFLD." Hepatology. IF=14.971
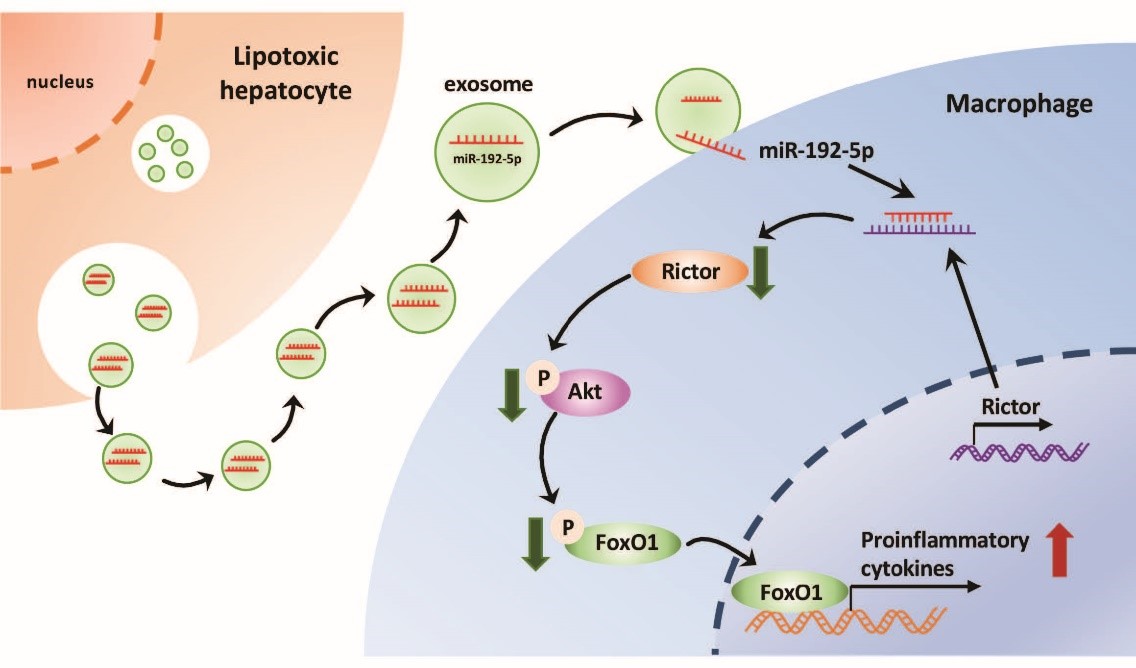 前期报道:https://www.exosomemed.com/6497.html
前期报道:https://www.exosomemed.com/6497.html
2. 成都医学院饶磊课题组:SPION-外泌体靶向胰腺给药以降低血糖
Zhuang, M., et al. (2019). "SPION-Decorated Exosome Delivered BAY55-9837 Targeting the Pancreas through Magnetism toImprove the Blood GLC Response." Small: e1903135. IF=10.856
前期报道:https://www.exosomemed.com/6491.html
3. 南京医科大学:人参来源的纳米颗粒改变巨噬细胞极化,抑制黑色素瘤的生长
Cao, M., et al. (2019). "Ginseng-derived nanoparticles alter macrophage polarization to inhibit melanoma growth." JImmunother Cancer 7(1): 326. IF=8.676
背景:尚不清楚植物源性细胞外囊泡(EV)是否可以介导与哺乳动物细胞的种间通讯。肿瘤相关的巨噬细胞(TAM)在杀肿瘤的M1表型和支持肿瘤的M2表型之间显示出连续的不同极化状态,其中较低的M1/M2比值与肿瘤的生长、血管生成和侵袭相关。该报道研究了人参EV是否可以在体外和体内改变M2样极化以促进癌症免疫治疗。方法:从人参分离并表征了一种新型的EVs样人参衍生纳米颗粒(GDNP)。使用GDNPs作为改变M2极化巨噬细胞的免疫增强剂,研究分析了用GDNPs处理的巨噬细胞的相关表面标志物、基因和细胞因子。用GDNPs疗法治疗携带B16F10黑素瘤的小鼠。评估肿瘤生长,并通过FACS和IF评估TAM人群。结果:GDNPs显著促进了M2向M1的极化,并产生了总的活性氧,导致小鼠黑素瘤细胞凋亡增加。发现GDNP诱导的M1极化取决于Toll样受体(TLR)-4和髓样分化抗原88(MyD88)介导的信号传导。此外,神经酰胺脂质和GDNPs蛋白可能通过TLR4激活在巨噬细胞极化中起重要作用。GDNPs治疗可显著抑制荷瘤小鼠中黑色素瘤的生长,并在肿瘤组织中检测到M1巨噬细胞的存在增加。结论:GDNPs可以在体内和体外改变M2极化,这有助于抗肿瘤反应。 GDNPs诱导巨噬细胞的极化很大程度上取决于TLR4和MyD88信号。GDNPs作为免疫调节剂参与哺乳动物的免疫反应,并可能代表癌症免疫疗法中的一类新的纳米药物。
4. 华中科技大学:自组装的人类脂肪干细胞胞外囊泡功能化的生物素掺杂的聚吡咯钛具有长期稳定性和潜在的成骨能力
Chen, L., et al. (2019). "Self-Assembled Human Adipose-Derived Stem Cell-Derived Extracellular Vesicle-FunctionalizedBiotin-Doped Polypyrrole Titanium with Long-Term Stability and PotentialOsteoinductive Ability." ACS Appl Mater Interfaces. IF=8.456
包含蛋白质或miRNA的间充质干细胞衍生的细胞外囊泡(MSC-EVs)具有多种生物学活性和低免疫原性,被认为有望对骨移植物进行表面修饰。但是,修饰效率尚未得到满足,导致治疗效果受损。该研究报告了一种新型的固定化方法,该方法通过将生物素化的MSC-EVs自组装到生物素掺杂的聚吡咯钛(Bio-Ppy-Ti)的表面上,以改善其在体内和体外的生物功能。使用这种方法,超声震荡30s后,锚定在Bio-Ppy-Ti表面上的人类脂肪干细胞EV(hASC-EV)的量比纯Ti的量高185倍,并且在30 s内保持稳定。与原始Ti相比,EV-Bio-Ppy-Ti在4摄氏度下持续14天。与原始Ti相比,EV-Bio-Ppy-Ti在异位骨形成模式下具有增强的细胞相容性和对成骨细胞的骨诱导能力,并具有抗凋亡能力。基因芯片分析进一步证明,几种骨诱导性miRNA被封装在hASC-EV中,这可以解释EV-Bio-Ppy-Ti的高骨再生能力。因此,这种MSC-EV生物素固定化方法对于骨移植物的生物活性修饰是高效且长期稳定的,证明了其在临床金属植入物中应用的潜力。
5.青岛大学&天津大学:通过pH响应方法分离的血液TfR+外泌体为肿瘤治疗提供化疗给药新途径
Yang, L., et al. (2019). "Blood TfR+ exosomes separated by a pH-responsive method deliver chemotherapeutics for tumortherapy." Theranostics 9(25): 7680-7696. IF=8.063
与其他类型的外泌体相比,血液转铁蛋白受体阳性(TfR+)外泌体是一种优化的药物传递载体,因为它们易于获取且具有很高的生物安全性。它们的应用促进了基于外泌体的运载工具从科研实验室到临床的转化。方法:在这项研究中,开发了一种基于pH响应的超顺磁性纳米粒子簇(SMNC)的方法,用于精确、温和地分离血液TfR+外泌体。简而言之,由于Tf对TfR的特异性识别,用转铁蛋白(Tfs)标记的多个超顺磁性纳米颗粒(SPMN)可以精确地与血液TfR+外泌体结合形成基于外泌体的簇。他们可以实现血液TfR+外泌体的精确磁分离。更重要的是,Tf和TfR的pH响应解离特性导致簇的轻度崩溃,从而获得纯的TfR+外泌体。结果:通过基于pH响应的SMNC方法成功获得了高纯度且处于原始状态的血液TfR+外泌体。由于它们固有的被动靶向能力,它们可以以约10%的负载量负载阿霉素(DOX),并显著增加DOX在荷瘤小鼠中的肿瘤蓄积。此外,血液中的TfR+外泌体改变了DOX的生物分布,从而减少了副作用。与游离DOX相比,载有DOX的血液TfR+外泌体对荷瘤小鼠表现出更好的肿瘤抑制作用。结论:利用Tf和TfR的pH响应结合和解离特性,基于SMNC的方法可以精确分离高纯度且处于原始状态的血液TfR+外泌体。所得的血液TfR+外泌体显示出极好的生物安全性,并能将化学治疗药物有效地递送至肿瘤,从而促进基于外泌体的药物递送系统的临床转化。
6. 浙江大学第二附属医院胡新央教授&第一附属医院黄进宇教授:海藻酸钠水凝胶中掺入小细胞外囊泡作为心肌梗死的新治疗策略
Lv, K., et al. (2019). "Incorporation of small extracellular vesicles in sodium alginate hydrogel as a novel therapeutic strategyfor myocardial infarction." Theranostics 9(24): 7403-7416. IF=8.063
骨髓间充质干细胞(MSC)衍生的小细胞外囊泡(sEVs)已被广泛用于治疗心肌梗塞(MI)。然而,低驻留率和短暂的治疗效果仍然是重大挑战。这项研究旨在确定海藻酸盐水凝胶中是否可包含MSC衍生的sEV,从而增加它们在心脏中的滞留率,从而改善治疗效果。方法:根据sEVs的释放能力和水凝胶的流变性,确定结合sEVs系统的最佳藻酸钠水凝胶。离体荧光成像用于评估心脏中sEV的保留。通过免疫荧光染色分析了sEVs的免疫调节和对血管生成的影响。超声心动图和Masson三色染色用于评估心脏功能和梗死面积。结果:藻酸盐水凝胶(sEVs-Gel)中掺入的sEV增强了sEV在心脏中的保留。与仅sEVs治疗(sEVs)相比,sEVs-Gel治疗可显著降低心肌梗死后第3天的心肌细胞凋亡并促进巨噬细胞的极化。sEVs-Gel治疗在梗死后四周也增加了疤痕厚度和血管生成。sEVs-Gel组的心脏功能和梗塞面积的测量结果明显好于仅用sEVs治疗的组。结论:藻酸盐水凝胶中掺入的sEVs的方法提供了一种无细胞治疗的新方法,并优化了sEVs对MI的治疗效果。
He, L., et al. (2019). "Ovarian cancercell-secreted exosomal miR-205 promotes metastasis by inducing angiogenesis." Theranostics 9(26): 8206-8220. IF=8.063
背景:通过提供氧气、营养物质和转移性导管,肿瘤血管生成对于癌症转移至关重要。癌细胞分泌的microRNA可包装到外泌体中,并牵涉到肿瘤血管生成的不同方面。但是,潜在的机制尚不完全清楚。方法:采用GEPIA数据库和原位杂交技术分析miR-205在卵巢组织中的表达。进行了免疫组织化学检查了miR-205和微血管密度之间的关系。通过RT-PCR和GEO数据库分析评估循环miR-205的表达。进行共培养和外泌体标记实验以评估外泌体miR-205从卵巢癌(OC)细胞向内皮细胞EC的转移。外泌体摄取测定法用于定义与外泌体miR-205的内吞摄取相关的细胞途径。体内和体外进一步研究了外泌体miR-205在血管生成中的作用。免疫印迹和rescue实验应用于检测外泌体miR-205对EC中PTEN-AKT途径的调控。结果:miR-205在OC组织中上调,而miR-205的高表达与OC患者的转移进展有关。此外,miR-205在癌旁的EC中高度富集,而OC患者中miR-205的上调与高微血管密度呈正相关。重要的是,miR-205在OC患者的血清中明显富集,循环外泌体中高水平的miR-205与OC转移有关。另外,源自OC的miR-205被分泌到细胞外空间并以外泌体依赖性方式有效地转移到相邻的EC,并且脂质筏相关途径在调节外泌体miR-205的摄取中起重要作用。来自OC细胞的外泌体miR-205在小鼠模型中显著促进了体外血管生成,并加速了血管生成和肿瘤的生长。此外,发现外泌体miR-205通过PTEN-AKT途径诱导血管生成。结论:这些发现证明了一种依赖于外泌体的机制,通过该机制,源自癌细胞的miR-205调节肿瘤血管生成并揭示外泌体miR-205或可作为OC的潜在治疗靶标。
8. 四川大学华西医院:注射式细胞外囊泡释放的自组装肽纳米纤维水凝胶作为增强的组织再生无细胞疗法
Zhou, Y., et al. (2019)."Injectable extracellular vesicle-released self-assembling peptide nanofiber hydrogel as anenhanced cell-free therapy for tissue regeneration." J Control Release316: 93-104. IF=7.901
间充质干细胞来源的细胞外囊泡(MSC-EVs)已显示出巨大的组织修复潜力,但其治疗能力受到快速清除和半衰期短的限制。该研究旨在基于水凝胶的缓释策略来增强EV的治疗效力。基质金属蛋白酶2(MMP2)敏感的自组装肽(KMP2)水凝胶用于MSC-EV的局部递送。分析了KMP2水凝胶的结构和控释特性。在患有肾缺血再灌注(I/R)损伤的小鼠中评估了EV载药KMP2水凝胶(KMP2-EVs)对细胞凋亡、炎症和血管生成的影响。在体外,KMP2形成了交联的纳米纤维水凝胶以包裹MSC-EV。KMP2响应MMP2表现出更大的降解和EV释放。释放的EV具有与新鲜分离的EV相似的结构和生物活性。在体内,与接受EV或KMP2的小鼠相比,用KMP2-EV治疗的I/R小鼠通过减少肾小管细胞凋亡、促炎性细胞因子表达和巨噬细胞浸润显示出改善的肾功能。此外,与单独使用KMP2或EV相比,KMP2-EV表现出更好的促进内皮细胞增殖和血管生成的功效,从而降低了I/R小鼠的慢性肾纤维化。这项研究强调,EV释放的KMP2水凝胶是用于组织修复的有前途的无细胞疗法。
Zhong, M. E., et al. (2019)."Serum extracellular vesicles contain SPARC and LRG1 as biomarkers of colon cancer anddiffer by tumour primary location." EBioMedicine. IF=6.68
背景:最近,左右结肠癌(LCC和RCC)之间的区别已成为关注焦点。RCC与总体生存率较低和无进展生存期相关。该研究旨在使用定量蛋白质组学对LCC和RCC之间的细胞外囊泡(EV)多样性进行详细分析,并确定新的诊断和预后生物标志物。方法:从患有LCC、RCC和健康志愿者的患者中分离出EV,并用血清来源的EV处理结直肠癌细胞系。然后,对血清来源的EV和经EV处理的细胞系进行了定量蛋白质组学分析。蛋白质组学数据可通过ProteomeXchange获得,其标识符为PXD012283和PXD012304。此外,评估了EV SPARC和LRG1作为结肠癌诊断和预后生物标志物的性能。结论:RCC患者血清EV蛋白质组的表达谱与LCC患者不同。与源自LCC的EV相比,RCC中的血清EV促进细胞移动性更显着。EV SPARC和LRG1的表达水平证明了观测者操作特性曲线值在0.95和0.93以下,可将结肠癌患者与健康对照区分开。此外,SPARC和LRG1的表达水平与肿瘤的程度相关,并预示着肿瘤的复发。解释:该研究发现了LCC和RCC之间的EV蛋白谱存在差异。RCC的血清源EV可能通过上调细胞外基质(ECM)相关蛋白(尤其是SPARC和LRG1)来促进转移,这些蛋白可作为结肠癌的诊断和预后生物标志物。
10. 复旦大学药学院:磷酸化的Rasal2促进乳腺癌的进展
Wang, X., et al. (2019)."Phosphorylated Rasal2 facilitates breast cancer progression." EBioMedicine. IF=6.68
背景:Rasal2对雌激素受体阳性(ER+)和阴性(ER-)乳腺癌的进展具有直接的作用。相关原因未知。还不清楚Rasal2的作用是否由外泌体转运过程介导。方法:从乳腺癌细胞中纯化外泌体,并通过透射电子显微镜和流式细胞仪进行鉴定。进行了体内和体外实验,以研究Rasal2在外泌体介导的乳腺癌进展中的作用。进行蛋白质印迹分析以检测ER+/ ER-乳腺癌细胞以及ER+或ER-乳腺癌患者的外泌体,癌组织和血液中的Rasal2和p-Rasal2(磷酸化Rasal2)表达。结果:Rasal2丝氨酸237的磷酸化促进了ER+和ER-肿瘤细胞和组织中的肿瘤生长。p-Rasal2和非p-Rasal2在调节乳腺癌进展中的功能都是外泌体介导的。ER+乳腺癌细胞和外泌体,癌组织和血液中的p-Rasal2表达明显低于ER-肿瘤细胞和患者。解释:p-Rasal2促进ER+和ER-乳腺癌的肿瘤进展。ER+和ER-乳腺癌中p-Rasal2/non-p-Rasal2的比率是决定Rasal2(或总Rasal2)在ER+乳腺癌中起抑制作用或在ER-乳腺癌中起促进作用的因素之一。因此,靶向Rasal2的磷酸化可用作通过降低p-Rasal2/非p-Rasal2的比例来抑制乳腺癌进展的疗法,特别是在ER-乳腺癌中。
11. 华南农业大学动物科学学院习欠云、张永亮课题组:肝脏外泌体来源的miR-130a-3p通过调节脂肪细胞来减弱葡萄糖耐量
Wu, J., et al. (2019). "Hepatic exosome-derived miR-130a-3p attenuates glucose intolerance via suppressingPHLPP2 gene in adipocyte." Metabolism 103: 154006. IF=6.513
前期报道:https://www.exosomemed.com/6456.html
12. 东南大学:直接从人全血进行精确的细胞外囊泡定量和蛋白质标记分析的集成微流控设备
Zhou, S., et al. (2019). "An Integrated Microfluidic Device for Accurate Extracellular Vesicle Quantification andProtein Markers Analysis Directly from Human Whole Blood." Anal Chem. IF=6.35
细胞外囊泡(EVs)具有被用作疾病特异性生物标志物的潜力。尽管最近开发了用于EV的芯片分离和检测的策略,但是它们需要对临床样品进行预处理,并且仅通过EV的浓度来判断其准确性不足以进行疾病诊断。该研究设计了一种名为血浆分离和EV检测(PS-ED)芯片的集成微流控设备,用于直接从临床全血样本中进行EV的血浆分离、定量和高通量蛋白质分析。该设备包括两个模块(PS和ED模块):PS模块是一个六回路微通道,用于在惯性力的作用下从临床全血样本中快速分离血浆,分离血浆中的EV值保持与初始血液样本一致。该模块减少了对血细胞的机械损伤,从而减少了在EV检测过程中碎片或细胞内容物对受损细胞的干扰; ED模块包含四个S通道,用于EV的定量和高通量蛋白质分析,检测范围从2.5×102至2.5×108颗粒/微升,检测极限为95颗粒/微升。通过同时监测EV的三种蛋白质(CD81、CD24和EpCAM),可以准确地确定癌症类型。此外,临床血液样本分析证明了该装置可用于卵巢癌的准确诊断和治疗监测。
13. 大连理工大学:通过膜靶向粘度探针和荧光寿命成像显微镜的结合反映外泌体的大小差异
Li, N., et al. (2019)."Reflecting Size Differences of Exosomes by Using the Combination of Membrane-Targeting Viscosity Probe and Fluorescence Lifetime Imaging Microscopy." Anal Chem. IF=6.35
外泌体是细胞分泌的膜包被的囊泡,其大小在30至150 nm之间。到目前为止,还没有简单、快速且经济的方法来评估生物系统中外泌体的大小。该报道提出了一个假设,其中的球体大小(导致不同的曲率)可能会影响外泌体膜的局部迁移率/粘度。基于此假设,该研究提出了一种通过量化膜粘度来评估外泌体大小的新方法。为此,设计了一种膜靶向分子转子,其荧光寿命对粘度敏感,并在荧光寿命成像显微镜(FLIM)下使用。通过多步超滤技术,从HeLa和MCF-7细胞培养基中分离出具有外泌体的三个个体大小分布(10-50、50-100和100-220 nm),然后对上述两组进行FLIM分析。在这两种情况下,确实找到了规则的模式,其中寿命反映的膜粘度随外泌体大小而降低。然后,对乳腺癌患者癌细胞,相应的正常组织细胞和血清中的外泌体进行测定。发现来自癌细胞的外泌体具有比正常组织细胞更长的荧光寿命(更大的粘度)。来自三阴性乳腺癌患者的外泌体的平均荧光寿命比HER2阳性的患者更长(或粘度更大)。因此,新的简单方法可能在未来的癌症诊断中具有应用前景。
14. 天津医科大学总医院雷平课题组:神经元外泌体携带miR-21-5p促进小胶质细胞的M1极化
Yin, Z., et al. (2019)."Neuron-derived exosomes with high miR-21-5p expression promoted polarization of M1 microgliain culture." Brain Behav Immun. IF=6.17
前期报道:https://www.exosomemed.com/6445.html
15. 复旦大学附属肿瘤医院:反向捕获可选择性和灵敏地揭示血清外泌体的N-糖基
Lv, J., et al. (2019)."Reverse capture forselectively and sensitively revealing the N-glycome of serum exosomes."Chem Commun (Camb) 55(95): 14339-14342. IF=6.164
外泌体正在成为疾病生物标志物的有希望的来源。但是,来自外泌体的聚糖的研究较少。该研究首次报道了人血清外泌体的N-糖基,并揭示了来自外泌体的N-聚糖作为生物标志物发现来源的潜力。
He, F., et al. (2019). "Probing exosome internalization pathways through confocal microscopy imaging." Chem Commun (Camb) 55(93):14015-14018. IF=6.164
该研究开发了一种新型的荧光标记方法,通过共聚焦显微镜跟踪细胞中的外泌体内化途径。所提出的方法允许评估和比较来自不同细胞的外泌体的摄取途径,这将为理解外泌体在细胞间通讯中的功能及其在药物递送中的应用提供潜力。
17. 中山大学第六附属医院:间充质基质细胞外泌体通过巨噬细胞依赖性机制减轻鼠结肠炎
Liu, H., et al. (2019)."Exosomes from mesenchymal stromal cells reduce murine colonic inflammation via amacrophage-dependent mechanism." JCI Insight. IF=6.014
炎性肠病(IBD)的常规治疗具有多种潜在的副作用。因此,迫切需要替代的治疗方法。这项工作表明,骨髓间充质基质细胞的外泌体(MSC-Exos)的全身性给药可在各种IBD模型中显著缓解结肠炎。MSC-Exos治疗可下调炎症反应,维持肠屏障完整性和极化的M2b巨噬细胞,但不利于肠纤维化。从机制上讲,注入的MSC-Exos主要作用于结肠巨噬细胞,而用MSC-Exos处理的小鼠与未处理的小鼠相比,来自结肠的巨噬细胞对炎症再刺激具有明显的抵抗力。巨噬细胞耗竭阻止了MSC-Exos的有益作用。此外,从巨噬细胞诱导IL-10产生部分参与了MSC-Exos的有益作用。MSC-Exos富含参与调节与MSC-Exos的抗结肠炎益处相关的多种生物过程的蛋白质。特别地,需要MSC-Exos中的金属硫蛋白-2来抑制炎症反应。综上所述,MSC-Exos是炎症反应的关键调节剂,可能是有希望的IBD治疗候选药物。
18. 第四军医大学韩骅课题组:神经元通过上调Cav-1增加内皮细胞衍生的细胞外囊泡的摄入,减缓神经元凋亡
Yue, K. Y., et al. (2019)."Neurons canupregulate Cav-1 to increase intake of endothelial cells-derived extracellular vesicles that attenuate apoptosis via miR-1290." Cell Death Dis 10(12):869. IF=5.959
前期报道:https://www.exosomemed.com/6487.html
19. 中山大学附属第六医院兰平、吴现瑞课题组:lncRNA RPPH1通过与TUBB3相互作用并促进外泌体介导的巨噬细胞M2极化来促进结直肠癌转移
Liang, Z. X., et al. (2019). "LncRNA RPPH1 promotes colorectal cancer metastasis by interacting with TUBB3 and bypromoting exosomes-mediated macrophage M2 polarization." Cell Death Dis10(11): 829. IF=5.959
前期报道:https://www.exosomemed.com/6442.html
20. 第三军医大学:肝细胞外泌体miR-194激活PMVECs并促进肝肺综合征中的血管生成
Chen, L., et al. (2019)."Hepatocyte-derived exosomal MiR-194 activates PMVECs and promotes angiogenesis in hepatopulmonary syndrome." Cell Death Dis 10(11): 853. IF=5.959
Guan, X., et al. (2019)."circPUM1 PromotesTumorigenesis and Progression of Ovarian Cancer by Sponging miR-615-5p andmiR-6753-5p." Mol Ther Nucleic Acids 18: 882-892. IF=5.919
22. 南京医科大学:BMSCs外泌体microRNA-9-3p下调ESM1抑制膀胱癌的发展
Cai, H., et al. (2019). "Exosomal MicroRNA-9-3p Secreted from BMSCs Downregulates ESM1 to Suppress theDevelopment of Bladder Cancer." Mol Ther Nucleic Acids 18: 787-800. IF=5.919
23. 【综述】华中科技大学同济医学院:外泌体miRNA和lncRNA在肺部疾病中的作用
Li, Y., et al. (2019). "The roles of exosomal miRNAs and lncRNAs in lung diseases." Signal Transduct Target Ther 4: 47. IF=5.873
24. 河北医科大学第二医院:外泌体lncRNAZFAS1通过microRNA-24/STAT3轴调控食管鳞状细胞癌细胞的增殖、侵袭、迁移和凋亡
Li, Z., et al. (2019)."Exosomal lncRNA ZFAS1 regulates esophageal squamous cell carcinoma cell proliferation, invasion,migration and apoptosis via microRNA-124/STAT3 axis." J Exp Clin CancerRes 38(1): 477. IF=5.646
25. 上海健康医学院附属周浦医院:由负载外泌体的天然生物聚合物制造高效自我修复水凝胶,以协同促进严重伤口愈合
Wang, C., et al. (2019). "The fabrication of ahighly efficient self-healing hydrogel from natural biopolymers loaded withexosomes for the synergistic promotion of severe wound healing." BiomaterSci. IF=5.251
26. 四川大学华西药学院:仿生细胞来源的纳米载体,用于调节免疫应答
Qin, M., et al. (2019). "Biomimeticcell-derived nanocarriers for modulating immune responses." Biomater Sci. IF=5.251
27. 上海交通大学医学院:用于治疗脑部疾病的仿生药物递送系统
Chen, Y. X., et al. (2019). "Biomimeticdrug-delivery systems for the management of brain diseases." Biomater Sci. IF=5.251
28. 吉林大学:circFMN2通过调节miR-1182/hTERT信号通路促进CRC中的肿瘤增殖
Li, Y., et al. (2019)."A Novel circFMN2 Promotes Tumor Proliferation in CRC by Regulating the miR-1182/hTERT Signaling Pathways." Clin Sci (Lond). IF=5.237
29. 华中科技大学同济医学院:来自耐吉西他滨的胰腺癌细胞的癌症干细胞的外泌体通过递送miR-210增强了耐药性
Yang, Z., et al. (2019)."Exosomes derivedfrom cancer stem cells of gemcitabine-resistant pancreatic cancer cells enhancedrug resistance by delivering miR-210." Cell Oncol (Dordr). IF=5.02
外泌体资讯网 国内外泌体领域进展总结(2019年11月)









