土豆
神经炎症是颅脑外伤后急性神经功能缺损和慢性外伤性脑病的特征性病理变化。小胶质细胞是参与神经炎症和神经元损伤的关键细胞,小胶质细胞极化的类型决定了神经炎症的方向。来自天津医科大学总医院雷平课题组的研究人员发现,颅脑外伤后神经元分泌外泌体中含有高水平的miR-21-5p,进而诱导了小胶质细胞的M1极化并带来神经炎症。该研究发表于Brain Behavior and Immunity杂志上。
颅脑外伤(Traumatic brain injury,TBI)是一个全球性的健康问题,每年约有超过五千万人患者,已成为所有国家各个年龄段的死亡和残疾的主要原因。TBI每年给全球经济造成的损失约为4000亿美元。神经炎症反应存在于TBI的急性和慢性阶段,甚至持续多年,患者具有反复发作的颅脑外伤史,导致进行性退行性疾病,例如慢性创伤性脑病(chronic traumatic encephalopathy,CTE)。CTE是一种进行性tau蛋白相关的神经退行性疾病,与运动员反复性脑震荡和临床上与爆炸引起的TBI相关。
神经炎性反应在TBI和CTE的病理过程中起着极其重要的作用。小胶质细胞是引起神经炎症反应的核心细胞,并且是调节神经炎症反应的重要靶标。小胶质细胞是大脑的常驻细胞,可调节大脑发育,维持神经元网络和神经系统修复。
小胶质细胞作为脑巨噬细胞,由于其独特的稳态表型和中枢神经系统微环境的严格调控,因此与其他组织巨噬细胞不同。小胶质细胞负责消除可能危害中枢神经系统的微生物、死细胞、多余的突触、蛋白质聚集体以及其他颗粒和可溶性抗原。此外,作为促炎细胞因子的主要来源,小胶质细胞是神经炎症的关键介质,可以调节广泛的细胞反应。小胶质细胞有两种极化表型:M1和M2型。 M1型小胶质细胞促进神经炎症反应,M2型小胶质细胞抑制神经炎症反应。小胶质细胞的极化表型决定了神经炎症的方向,这与TBI和CTE的病理密切相关。小胶质细胞极化类型的调控是影响神经炎症反应、促进TBI和CTE神经功能恢复的重要机制。
miRNA是一类小非编码RNA,在RNA沉默中起指导分子的作用。miRNA以大多数蛋白质编码转录本为靶标,几乎参与了所有发育和病理过程。研究团队此前发现, TBI后大脑中miR-21-5p的表达水平增加,miR-21-5p在TBI后的血管内皮、神经胶质细胞特别是神经元中明显表达,miR-21-5p的转染可以显著改善神经元和神经血管内皮细胞的凋亡过程。但是,miR-21-5p在小胶质细胞的极化以及神经元细胞与小胶质细胞之间的相互作用中还未有研究。
外泌体,一种小的脂质微囊泡(50-150nm),在生理和病理生理中起着至关重要的作用。作为一种活跃的生物容器,外泌体通过在细胞之间转移蛋白质和遗传信息来介导细胞间的通讯。由于miR-21-5p在神经元和小胶质细胞之间的运输机制尚不清楚,外泌体可能是在神经元和小胶质细胞之间携带miR-21-5p的载体。
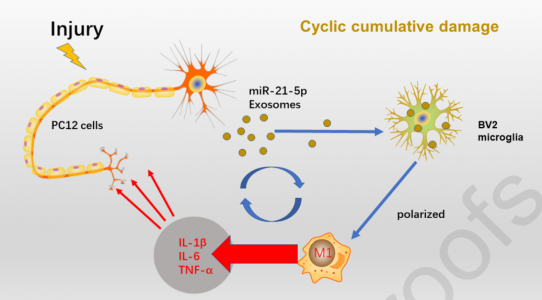
在这项研究中,研究人员猜想,TBI发生后,来自神经元的miR-21-5p后通过外泌体作用于小胶质细胞,促进小胶质细胞极化。研究结果显示,含有miR-21-5p的PC12(代表神经元)细胞衍生的外泌体被小胶质细胞吞噬并诱导了小胶质细胞的极化。同时,miR-21-5p在M1小胶质细胞中的表达增加。M1小胶质细胞的极化加剧了神经炎症因子的释放,抑制了神经突的生长,增加了P-tau的积累并促进了PC12细胞的凋亡,从而形成了循环累积性损伤的模型。因此,含有miR-21-5p的PC12衍生的外泌体是这种循环累积损伤模型的基本要素,调节miR-21-5p的表达或外泌体的分泌可能是治疗TBI后神经炎症的重要新策略。
参考文献:Yin Z, Han Z, Hu T, Zhang S, Ge X, Huang S, Wang L, Yu J, Li W, Wang Y, Li D, Zhao J, Wang Y, Zuo Y, Li Y, Kong X, Chen F, Lei P. Neuron-derived exosomes with high miR-21-5p expression promoted polarization of M1 microglia in culture. Brain Behav Immun. 2019. doi:
10.1016/j.bbi.2019.11.004.