作者:土豆
小胶质细胞在缺血性视网膜疾病的病理生理学过程中至关重要,但是小胶质细胞分泌的外泌体在在缺氧诱导的视网膜病变中的作用仍不清楚。近日,来自空军军医大学西京医院眼科王雨生课题组的研究人员在Molecular Therapy-Nucleic Acids杂志(IF 5.919)上发表文章,他们发现小胶质细胞分泌的外泌体介导了视网膜小胶质细胞与光感受器之间的联系,促进了氧诱导的视网膜病变小鼠的正常血管生成和视觉功能。该研究也提示了外泌体在早产儿视网膜病变的潜在治疗价值。
早产儿视网膜病变(retinopathy of prematurity, ROP)是未成熟或低体重出生婴儿的增殖性视网膜病变,主要表现在未完全血管化的视网膜在氧诱导下产生的缺血性新血管形成。ROP的发生对视力发育具有长期的不良影响,被认为是全球儿童失明的主要原因之一。
小胶质细胞传统上被认为是一种先天性免疫细胞,但是目前认为小胶质细胞不仅仅是炎症细胞,而且也参与中枢神经系统(CNS)的正常发育。研究表明,小胶质细胞还参与视网膜的正常血管发育。然而,包括视网膜小胶质细胞在内的小胶质细胞在血管发育中的作用还有待明确。
课题组的研究人员在前期已经做了大量的相关工作。研究团队发现,用米诺环素抑制小胶质细胞活化后会加重氧诱导的视网膜病变(oxygen-induced retinopathy,OIR)小鼠模型的视觉损伤和血管病变。此外,研究发现BALB / c小鼠的小胶质细胞密度要远高于C57小鼠;在视网膜病变小鼠模型中,C57小鼠表现出显著的血管破坏和新生血管簇形成;而BALB / c小鼠在相同条件下未形成明显的新生血管簇,并在恢复常氧后中央无血管区域血运重建非常迅速。这些结果说明,视网膜小胶质细胞密度的差异可能导致了两种疾病模型中血管表现的差异。
外泌体是直径40-150nm的纳米颗粒,来源于多泡体的胞吐作用,并通过向受体细胞转移微小RNA(miRNA)、mRNA和蛋白质在细胞间通讯中发挥多种生理作用。因此,近年来对外泌体的形成、包装、运输、功能和临床应用的研究成为了热点。
研究表明,小胶质细胞来源的外泌体参与了许多神经退行性疾病的进程。并且,来源于人间充质干细胞的外泌体通过阻止视网膜细胞凋亡并减少视网膜新生血管形成,降低了OIR小鼠模型中的视网膜缺血症状。
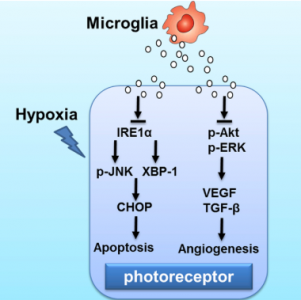
在这项研究中,研究人员发现来自小胶质细胞的外泌体有助于光感受器损伤后的治疗,并可能抑制早产儿视网膜病变(ROP)期间促血管生成因子的分泌,这表明外泌体可能会成为ROP治疗的选择。研究人员将小胶质细胞分泌的外泌体注射到氧诱导的视网膜病变(OIR)的小鼠模型的玻璃体中。结果显示,与对照组相比,外泌体处理后的OIR模型小鼠表现出更小的无血管区域和更少的新生血管簇,同时血管内皮生长因子(VEGF)和转化生长因子β(TGF-β)表达降低。此外,外泌体的注射抑制了光感受器细胞凋亡。在机制上,小胶质细胞的外泌体在体外传递到光感受器中,抑制IRE1α- XBP1级联通路,促进了缺氧诱导的光感受器细胞凋亡。此外,外泌体还下调缺氧诱导下的光感受器中VEGF和TGF-β的mRNA和蛋白水平。 microRNA测定显示microRNA-24-3p(miR-24-3p)水平在小胶质细胞外泌体中极高,表明这可能是抑制光感受器中缺氧诱导的IRE1α表达的关键分子。
因此,本研究通过建立OIR模型以及外泌体的玻璃体内注射方法,揭示小胶质细胞衍生的外泌体促进光感受器的存活并抑制体外缺氧介导的促血管生成因子分泌。
参考文献:Xu W, Wu Y, Hu Z, Sun L, Dou G, Zhang Z, Wang H, Guo C, Wang Y. Exosomes from Microglia Attenuate Photoreceptor Injury and Neovascularization in an Animal Model of Retinopathy of Prematurity. Mol Ther Nucleic Acids. 2019 Jun 7;16:778-790.