作者:企鹅
脂肪组织是一种高度动态的代谢器官,在调节能量稳态中起着重要作用。除了作为能量储存的主要部位之外,脂肪组织通过分泌大量生物活性肽(脂肪因子)和代谢物(例如鞘脂)来控制葡萄糖代谢和全身胰岛素敏感性。慢性营养过剩通常导致脂肪组织的不健康扩张和重塑,导致炎症,这是肥胖相关的心脏代谢综合征以及神经退行性疾病的主要罪魁祸首。来自动物研究和临床研究的数据表明,“发炎的”脂肪组织(尤其是内脏脂肪)是与肥胖相关的全身性低度炎症的主要原因。选择性抑制脂肪主要炎症通路(如JNK和NF-κB)足以抵消肥胖相关的全身性炎症、胰岛素抵抗和代谢失调。
在肥胖的进展期间,脂肪组织的扩张引起先天性和适应性免疫中免疫细胞的浸润和活化,这在组织内引发一系列急性和慢性炎症反应。虽然肥胖早期的急性炎症可以作为适当的脂肪组织扩张和有毒脂质储存所需的适应性反应,但脂肪组织中未解决的慢性炎症对心脏代谢健康造成一系列有害后果。在脂肪中驻留的免疫细胞中,巨噬细胞是最丰富的细胞类型,占肥胖脂肪组织总细胞的50%。在来自肥胖小鼠和人类受试者的脂肪组织中观察到巨噬细胞的浸润增加,形成围绕正在死亡或已经死亡脂肪细胞的冠状结构(crown-like structures, CLS)。脂肪组织中驻留的巨噬细胞(adipose tissue–resident macrophages, ATM)的数量与胰岛素抵抗和代谢失调的程度密切相关,而通过遗传或药理学方法选择性去除ATM足以逆转肥胖小鼠的胰岛素抵抗和葡萄糖耐受不良。
巨噬细胞本质上是高度可塑性的,表现出不同的表型,从经典活化的促炎性M1到交替活化的抗炎M2,以响应不断变化的环境。瘦肉脂肪组织由M2巨噬细胞群体主导,其通过吞噬脂肪细胞的吞噬作用和抗炎细胞因子的分泌以及血管生成、脂肪生成和适应性产热的其它调节因子在维持组织的正常功能和稳态中起关键作用。然而,在肥胖进展期间,ATM经历从抗炎M2到促炎性M1的表型转换,其产生促炎因子以加剧炎症和胰岛素抵抗。骨髓细胞中PPARγ破坏的小鼠巨噬细胞活化受抑制并且易于饮食诱导的胰岛素抵抗,而Th2细胞因子使巨噬细胞表达PPARδ/β诱导M2巨噬细胞的极化并增强胰岛素敏感性。以前的研究已经确定了从嗜酸性粒细胞,CD4+ T细胞或自然杀伤细胞产生的许多2型细胞因子(IL-4和IL-13),这些细胞因子对维持ATM的M2极化很重要。然而,脂质负荷的肥厚性脂肪细胞如何发送信号以触发肥胖的ATM渗透并改变其极化仍然知之甚少。
miRNAs是内源性小非编码RNA,通过直接结合靶mRNA的3'-非翻译区(3'-UTR)在转录后调节基因表达。miRNAs在过多的生理过程中起着重要作用,它们的调节异常与各种疾病的发病机制有关,包括肥胖、糖尿病和糖尿病并发症。特别是,脂肪组织中存在大量miRNAs,积极参与局部组织中脂肪生成、脂肪因子分泌、炎症和细胞间通讯的调节。此外,部分miRNAs可以被包装到脂肪来源的微泡中并被输送到血流中,充当激素样分子以促进关键代谢器官之间的交流。因此,脂肪来源的miRNAs作为肥胖相关代谢并发症的诊断生物标志物和治疗靶标具有很大的前景。
在基于微阵列的脂肪组织中miRNAs分析中,研究人员观察到饮食-肥胖小鼠内脏脂肪中miR-34a的显著上调。巧合的是,肥胖人的脂肪组织中miR-34a的表达也增加,并且与胰岛素抵抗的程度相关。为了解析miR-34a在肥胖相关的脂肪炎症和代谢功能障碍中的病理生理作用,来自香港大学的徐愛民课题组构建了脂肪组织选择性miR-34a-KO小鼠。相关工作发表在最新的The Journal of Clinical Investigation杂志上。研究结果表明,脂肪选择性敲除miR-34a使小鼠对肥胖诱导的胰岛素抵抗、葡萄糖耐受不良和肝细胞增多症有抵抗力,所有这些都归因于ATM的改变。因此,该团队进一步研究了miR-34a通过调节巨噬细胞生物学调节肥胖诱导的代谢炎症的机制和临床意义。
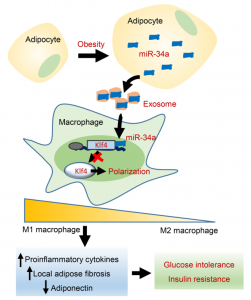
该研究鉴定了脂肪细胞分泌的miR-34a作为关键介质参与脂肪驻留巨噬细胞的旁分泌作用。随着饮食肥胖的发展,miR-34a在脂肪组织中的表达逐渐增加。脂肪选择性或脂肪细胞特异性miR-34a-KO小鼠对肥胖诱导的葡萄糖耐受不良、胰岛素抵抗和全身性炎症具有抗性,并且这伴随着脂肪驻留巨噬细胞从促炎性M1到抗炎性M2的极化显著变化。机制上,成熟的脂肪细胞分泌的外泌体将miR-34a转运到巨噬细胞中,从而通过抑制Krüppel样因子4(Klf4)的表达来抑制M2极化。miR-34a对M2极化的抑制作用及其对炎症反应的刺激通过在骨髓来源的巨噬细胞和肥胖小鼠的脂肪库中异位表达Klf4而被逆转。此外,超重/肥胖受试者的内脏脂肪中miR-34a表达增加与Klf4表达降低呈负相关,但与胰岛素抵抗和代谢炎症参数呈正相关。总之,miR-34a是脂肪细胞分泌的外泌体囊泡的关键组分,其将营养物超载的信号传递给脂肪驻留的巨噬细胞,导致肥胖诱导的全身性炎症和代谢失调的恶化。
脂肪细胞分泌的外泌体miR-34a在肥胖诱导的巨噬细胞极化、脂肪炎症和胰岛素抵抗改变中的作用示意图
参考文献:
Pan Y, Hui X, Hoo RLC, Ye D, Chan CYC, Feng T, Wang Y, Lam KSL, Xu A. Adipocyte-secreted exosomal microRNA-34a inhibits M2 macrophage polarization to promote obesity-induced adipose inflammation. J Clin Invest. 2019 Jan 22. pii: 123069. doi: 10.1172/JCI123069. [Epub ahead of print] 影响因子13.251