土豆
肿瘤来源的外泌体具有作为生物标记物的巨大潜力,但是有效的分离和检测方法仍然具有挑战性。来自华东理工大学的研究人员开发了一种两阶段微流体平台(ExoPCD芯片),集成了血清外泌体分离和原位电化学分析,能快速地进行复杂生物流体中外泌体分离及下游分析。这种微流体芯片有希望作为综合的外泌体分析工具和潜在的非侵入性诊断平台。
肿瘤细胞向周围的肿瘤基质中分泌各种类型的体液因子,其中外泌体可作为肿瘤微环境中细胞间通讯的传递介质。外泌体是膜封闭的磷脂纳米囊泡(直径30-150nm),由各种正常细胞和肿瘤细胞通过胞吐途径分泌。在质膜融合分泌和吸收的过程中,外泌体携带富含的四次跨膜蛋白(CD9,CD63,CD81)、细胞质蛋白、mRNA和microRNA来自其亲代细胞。这些原始特征赋予肿瘤特异性外泌体以独特的机会作为潜在的肿瘤生物标志物,可用于识别早期肿瘤并非侵入性地监测治疗反应。
然而,外泌体的小尺寸和低浮力密度对其在复杂生物流体中的分离和定量提出了重大挑战。传统的超速离心分离需要繁琐的步骤和昂贵的仪器,这可能导致低回收率和高费用。广泛用于外泌体定量的标准方法,如酶联免疫吸附测定(ELISA)和蛋白质印迹受到大样品需求和低灵敏度制约。此外,在这些单独的多步骤工作流程中进行外泌体分析可能非常耗时且容易受到污染。
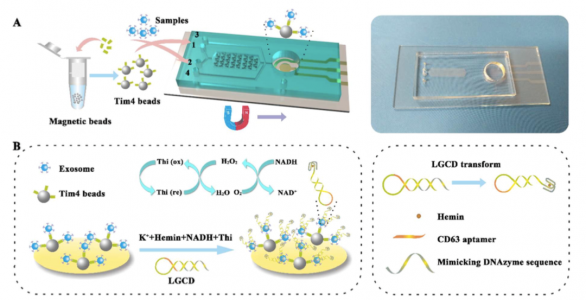
微流体技术的最新进展提供了在微小芯片上构建外泌体综合分析平台的可行性。据报道,基于纳米声学过滤器、粘弹性流体分选、侧向位移或免疫亲和的微流体平台可专门从生物体液中分离外泌体。作为最常用的分离方法,免疫亲和能够基于特定表面蛋白的表达分离外泌体的特定亚群。即便如此,较强的抗体抗原相互作用使得在温和洗脱条件下难以从结合抗体中洗脱外泌体。在外泌体膜上表达的磷脂酰丝氨酸(PS)可被PS结合受体Tim4很好地识别,这似乎对于晚期胞内体中的外泌体发芽是必需的。用Tim4固定化的磁珠捕获外泌体是Ca2+依赖性的,因此完整的外泌体可以通过螯合剂容易地被洗脱。
受这种新型亲和方法的启发,该研究团队提出了一个两阶段的微流体平台(ExoPCD芯片),它集成了血样中外泌体的芯片分离以及原位电化学分析。微芯片由一系列Y形微柱和级联的ITO电极组成。PDMS微柱阵列可以一次又一次地有效地进行交叉混合,以增强Tim4修饰磁珠和外壳之间碰撞的机会。通过在ITO电极表面上的磁性富集可以灵敏地检测并捕获的外泌体,形成了一种新的信号转导策略。
考虑到对便携和敏感的需求,研究人员设计了一种无标记且无固定化的电化学适体传感器(命名为LGCD),其含有CD63(外泌体表面的富集标记)适体并模拟DNA酶序列。单链DNA形成发夹结构,并且链中富含G的模拟DNA酶序列被笼蔽在茎环结构中。靶向CD63阳性外泌体可以打开原始的单链DNA发夹并在氯化血红素的帮助下形成G-四链体作为信号报告基因。hemin/ G-quadruplex可同时用作NADH氧化酶和HRP模拟DNA酶。因此,NADH氧化新产生的H2O2可以连续催化,伴随着明显的信号增强。与报道的用于外泌体检测方法的蛋白质修饰电极不同,新提出的外泌体探针可以方便地用于微流控芯片,无需昂贵的核酸修饰、复杂的固定化过程和信号放大。
在这项研究里,ExoPCD芯片可以有效捕获肿瘤来源的外泌体,并在小体积样品(30μL)中3.5小时内捕获。最重要的是,研究人员分析了确诊肝癌患者的临床血液样本,并与健康对照进行了比较。外泌体和肿瘤发生之间的正相关进一步证明了ExoPCD芯片在临床应用和癌症诊断中的潜在可用性。
该外泌体分离分析平台示意图
参考文献:Xu H, Liao C, Zuo P, Liu Z, Ye BC. Magnetic-Based Microfluidic Device for On-Chip Isolation and Detection of Tumor-Derived Exosomes. Anal Chem. 2018 Nov 20;90(22):13451-13458.