系统性红斑狼疮(Systemic lupus erythematosus,SLE)是由于免疫功能紊乱造成以自身免疫性炎症为特点的弥漫性结缔组织病。患者往往多器官受累,其中肾脏受累导致的狼疮肾炎(Lupus nephritis,LN) 是SLE的重要临床表现。目前,SLE的治疗主要依赖于非甾体类抗炎药、抗疟药、糖皮质激素等免疫抑制剂。然而,长期使用免疫抑制剂会造成感染等并发症,亟需探索新的更安全有效的治疗策略。自身免疫性B细胞的成熟和异常活化、增殖及向浆细胞分化并产生自身抗体,是SLE及其引起LN的主要原因。B细胞的成熟和存活依赖增殖诱导配体APRIL和B细胞激活因子BLyS。跨膜蛋白激活剂和亲环素配体相互作用分子TACI是这两种细胞因子作用B细胞的受体。利用TACI同时中和过多的BLyS和APRIL,从而抑制自身反应性B细胞的发育成熟和自身抗体的产生。外泌体(Exosome)是由细胞分泌的一种直径在 30~150 nm 的膜结构囊泡,作为细胞衍生的纳米级囊泡,携带各种生物分子,包括核酸、蛋白和脂质。外泌体免疫源性低、穿透能力强,是潜在的下一代替代全细胞输注的新型治疗策略。
2025年6月2日,中国医学科学院基础医学研究所何维/张建民教授研究团队在Journal of Controlled Release期刊在线发表题为“Genetically engineered extracellular vesicles expressing decoy protein TACI provide a therapeutic effect in systemic lupus erythematosus mouse model”的研究论文。该研究开发了一款装载诱饵蛋白TACI的基因工程化细胞外囊泡,能有效结合细胞因子BLyS,抑制BCMA-NF-κB报告基因细胞信号转导。
在这项研究中, 体内实验结果显示TACI工程化囊泡通过阻断BLyS/APRIL信号通路,显著减轻了SLE小鼠的病情并降低了炎性肾损伤,这表明TACI工程化囊泡具有抑制自身免疫、延长生存期以及改善SLE小鼠狼疮性肾炎的治疗潜力,是一种有前景的创新疗法。
研究者将TACI诱饵蛋白与N-SYN1结构域融合表达,使TACI富集在外泌体表面。通过纳米流式、透射电镜以及蛋白免疫印迹对纯化的外泌体进行表征分析,成功获得了高表达诱饵蛋白的TACI-EV。为了验证TACI-EV的生物学功能,研究者利用结合动力学实验检测TACI-EV与BLyS的亲和力,利用BLyS激发产生荧光素酶表达的BCMA-NF-κB报告基因细胞检测TACI-EV的阻断作用。实验结果发现,与Control-EV相比,TACI-EV对BLyS诱导的发光信号有显著抑制作用且有剂量依赖性。此外,利用SLE转基因模型MRL/Lpr小鼠,研究了TACI-EV在体内治疗自身免疫性疾病的疗效。结果显示,与Control-EV相比,TACI-EV治疗组能够显著降低小鼠血清BLyS、APRIL的水平,改善小鼠皮肤损伤,降低血清尿素氮、肌酐水平,改善蛋白尿,减轻肾脏损伤及免疫复合物沉积,显著延长SLE小鼠的生存期(图1所示)。
这项研究表明TACI-EV能够有效阻断BAFF/APRIL信号通路,通过免疫疗法抑制B细胞激活和自身抗体产生,有望为SLE的临床治疗提供新思路。
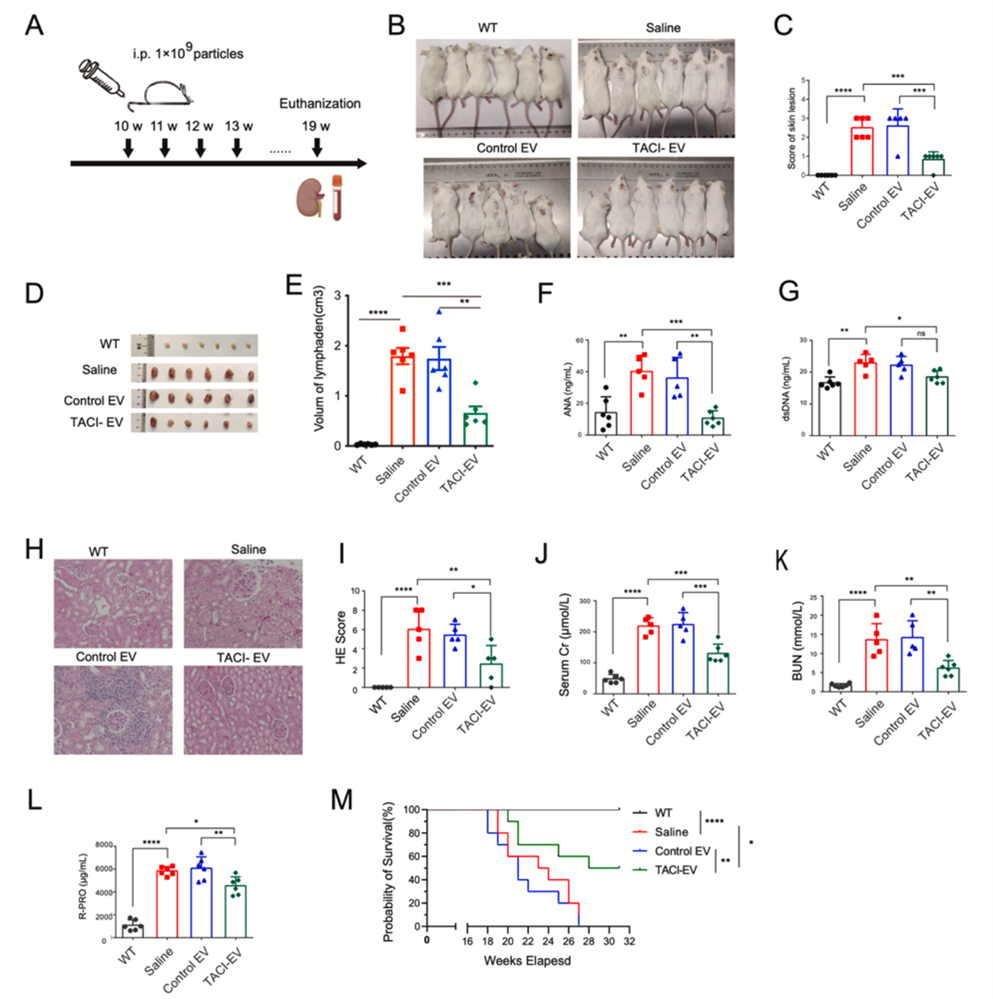
图1 TACI工程化外泌体有效改善SLE狼疮小鼠
该研究工作得到国家重点研发计划(2022YFC3602004)、医科院创新工程(2021-I2M-1-005,2021-I2M-1-035,2023-I2M-2-005)的资助。基础医学研究所张建民教授、何维教授和陈慧教授为论文的共同通讯作者,蔡孟华博士、田丰博士为论文的共同第一作者。
参考文献:
Genetically engineered extracellular vesicles expressing decoy protein TACI provide a therapeutic effect in systemic lupus erythematosus mouse model, J Control Release. 2025 May 25:384:113886. doi: 10.1016/j.jconrel.2025.113886.
原文链接:https://doi.org/10.1016/j.jconrel.2025.113886
外泌体资讯网 J Control Release|中国医学科学院何维/张建民:装载诱饵蛋白TACI的工程化细胞外囊泡有效治疗系统性红斑狼疮





