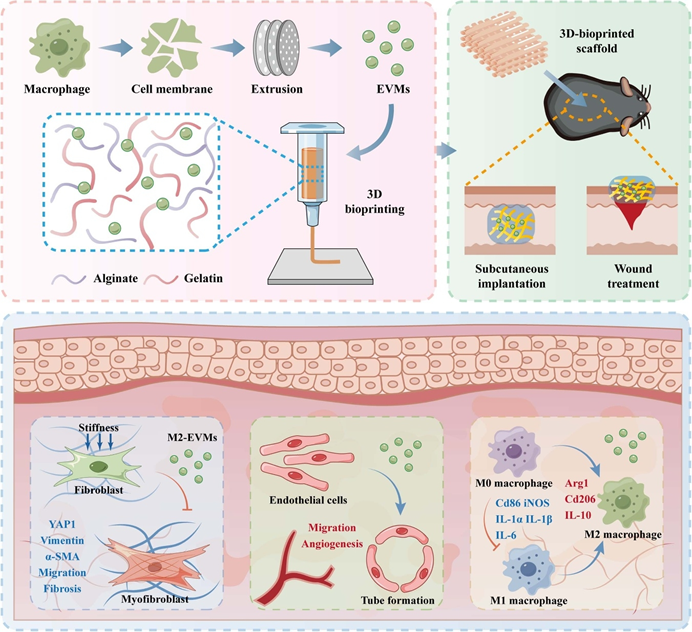
移植供体短缺是再生医学面临的关键挑战。近年来,生物3D打印技术成为构建高度仿生的工程组织替代物的有效方法。然而,生物3D打印组织的临床转化面临异物反应(foreign body reaction, FBR)和血管化不足的难题,这阻碍了移植物与宿主的成功整合。团队前期研究发现,FBR的加重与植入物的机械性能及异常M1型巨噬细胞极化高度相关。大量研究表明,M2型巨噬细胞具有强大的抑炎功能与促血管效能,因此,使打印体植入后的免疫应答偏向M2表型进而避免过度炎症,同时构建利于血管生长的微环境,有望增强生物3D打印植入物的整合能力和改善组织再生。然而,直接应用活体细胞面临体内表型可塑性、伦理问题和成本相关挑战,从培养物上清液中直接分离外泌体的方法受到操作复杂、产量低以及批次效应等限制。
近日,中国人民解放军总医院付小兵院士、黄沙教授团队在生物制造领域知名期刊Biofabrication上发表题为“Bioprinted M2 macrophage-derived extracellular vesicle mimics attenuate foreign body reaction and enhance vascularized tissue regeneration”的论文。首次将工程化膜挤压法制备的M2型巨噬细胞衍生细胞外囊泡模拟物(extracellular vesicle mimics, EMVs)作为生物墨水添加剂,用以缓解打印体植入后的FBR并促进血管化组织再生。文章第一作者为张超博士、付泽博士、刘清华硕士和郭旭硕士,主要通讯作者为黄沙教授等。

该研究通过膜挤压法制备了M2-EVMs,通过蛋白组学测序明确了其具有丰富的抗炎、抗机械响应及促血管化成分。体外实验中,M2-EVMs表现出优异的抗纤维化、促血管及抑制过度M1极化作用。以明胶-海藻酸钠生物墨水为应用实例,M2-EVMs添加后不会影响生物墨水基本物理性质且自身功能稳定有效。在皮下埋植和创面治疗模型中,M2-EVMs不仅展现出强大的免疫调节能力,还发挥了多效促再生作用,可有效地促进血管化、再上皮化和附属器再生。
以上结果证明,M2-EVMs为提高生物工程组织的存活率提供了一种简单高效的方法。此外,其可进一步作为靶向载药系统递送特异性药物进而赋予生物墨水更多功能,进一步改善临床结果并促进再生医学的发展。
参考文献:
Bioprinted M2 macrophage-derived extracellular vesicle mimics attenuate foreign body reaction and enhance vascularized tissue regeneration. Biofabrication, 17(3), 10.1088/1758-5090/add49f. https://doi.org/10.1088/1758-5090/add49f
外泌体资讯网 Biofabrication|中国人民解放军总医院付小兵/黄沙/杜晓辉:生物3D打印M2-EVMs减轻异物反应增强血管化组织再生




