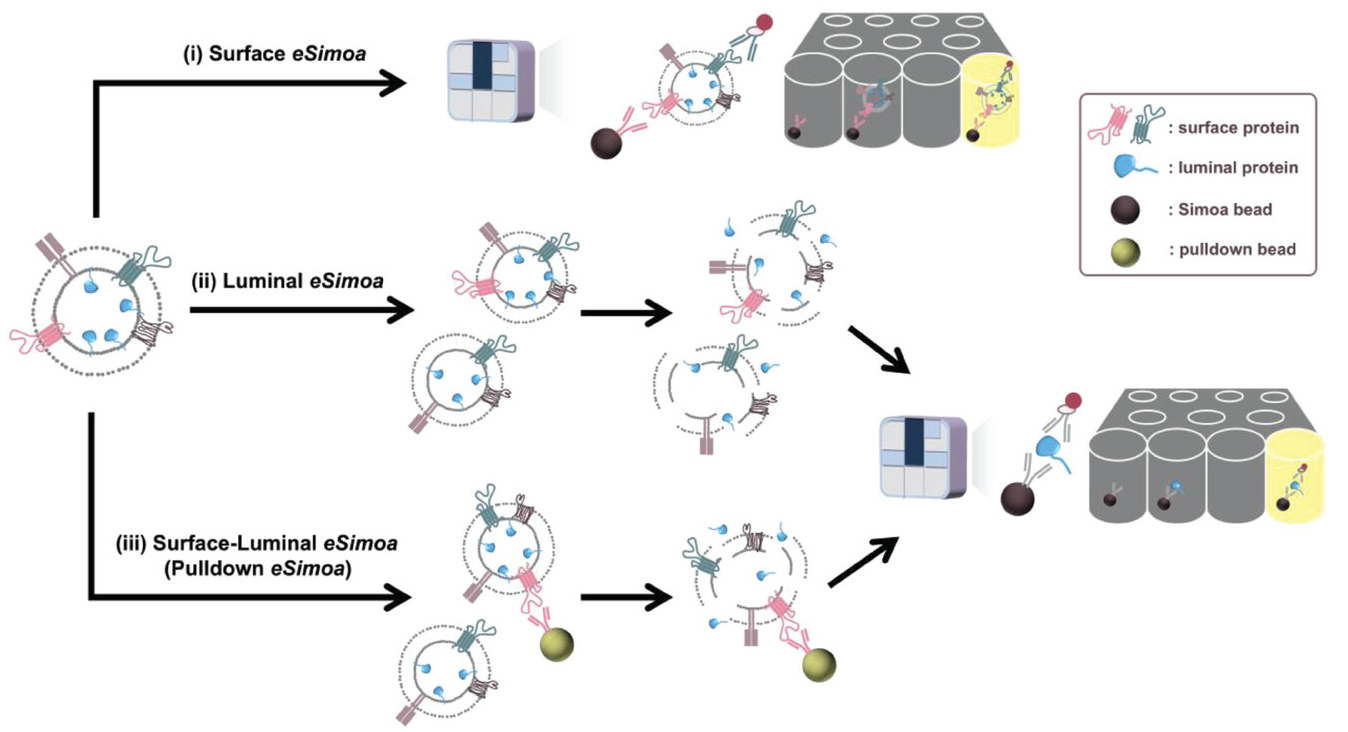
定位于肿瘤来源的细胞外囊泡(EVs)表面或腔内的蛋白在癌症进展中发挥着不同的作用。然而,由于现有蛋白检测方法的有限灵敏度和低效EV分离技术,对EVs内外蛋白的定量分析一直受到限制。近日,来自中国台湾的研究人员提出了一种称为eSimoa的框架,能够以高灵敏度和特异性对EV蛋白标志物进行空间解码,准确测量了EV腔内RAS或KRASG12D蛋白的绝对浓度,以及低丰度EV亚群体的绝对蛋白浓度,突显了eSimoa在临床样本中识别疾病特异性EV蛋白标志物方面的潜力。相关内容以“Ultrasensitive and High-Resolution Protein Spatially Decoding Framework for Tumor Extracellular Vesicles”为题在线发表于11月20日的国际先进材料学术期刊Advanced Science上。
细胞外囊泡(EVs)是由脂质双层包裹的异质性纳米颗粒,由包括肿瘤细胞体内的所有细胞释放。EVs作为核酸、蛋白质和脂质的载体,促进细胞间通信,并提供有关母细胞特征和疾病的内容。分析和“解码” EVs携带的空间分隔信息可能揭示其母细胞,即起源细胞,的身份和生物特征。肿瘤细胞在肿瘤发生早期积极释放EVs,而这些循环肿瘤来源的EVs在疾病进展中发挥着至关重要的作用。在肿瘤学中使用的传统液体活检中,包括循环肿瘤细胞(CTCs)、循环肿瘤DNA(ctDNA)和EVs,EVs在分离和检测方面具有长期存储的优势。血液中EVs的丰度远远超过CTCs的数量和来自给定基因的ctDNA的量。这种浓度上的显著差异突显了循环肿瘤来源的EVs作为“生物标志物库”的潜力,相比CTC、ctDNA和可溶性蛋白,它提供了更深层次的信息。此外,EVs是由活细胞积极分泌的,而ctDNA主要反映死亡或凋亡细胞的状态。因此,肿瘤来源的EVs有望作为癌症诊断、预后和治疗监测的一种微创方法,适用于所有疾病阶段,特别是在及时干预可以显著改善临床结果的早期疾病阶段。在该领域,循环肿瘤EVs的分析一直是一个重要挑战。循环肿瘤EVs仅占循环EVs总数的极小部分,而后者起源于各种不同的细胞和组织类型,大小和蛋白质含量巨大地多样化。虽然已经为人类癌症建立了肿瘤特异性生物标志物,但这些标志物只有一部分存在于循环肿瘤EVs中,它们的丰度通常非常低,特别是在早期癌症中。现有方法受到有限灵敏度的困扰,使得难以检测罕见的肿瘤EV亚群体中的蛋白质,尤其是在早期疾病中。这些方法通常依赖于繁琐的预处理步骤,如超速离心、密度梯度离心和尺寸排阻色谱来富集EVs,然后通过手动测定来表征分离的EVs。然而,这个工作流程耗时、劳动密集,缺乏精确性,使得在临床中大规模实施变得具有挑战性。此外,这些方法通常将EVs作为一个整体群体进行分析,不能解剖EV亚群体之间固有的异质性。为了克服这些限制,有必要开发用户友好且灵敏的工具,可以量化与疾病相关的特定EV关联蛋白标志物。基于抗体和寡聚核苷酸(aptamers)的方法已被探索用于分析与EV相关的蛋白质生物标志物。与aptamers相比,抗体分析生物标志物具有一些优势:它们已经得到了确认,在商业上是可获得的,在临床应用中广泛使用,对目标抗原高度特异,并且对核酸酶降解具有抵抗力。这些抗体的优势使它们成为在生物流体中捕获EVs的理想工具。然而,基于抗体的方法面临的挑战包括血液中这些蛋白质以可溶性形式的存在。此外,在复杂的临床样本中,试剂的非特异性结合和内在噪声可能引入干扰EV相关蛋白研究的背景信号,尤其是对于罕见的目标蛋白质。EV相关蛋白的一个区别特征是它们在离散的空间区域内的亚定位。它们可以暴露在EV的外表面上,锚定在内膜上,或存在于EV腔室内。来自不同区域的蛋白质可能表现出不同的生化特性,并在癌症进展中发挥互补作用。例如,腔室蛋白质可以包括突变的肿瘤抑制蛋白、致癌蛋白和关键的信号传导介质,使它们可能成为高度特异的癌症生物标志物。尽管质谱等技术在理论上可以检测腔室蛋白质,但由于血液样本中其他等级的蛋白质(例如白蛋白、免疫球蛋白)相对于EV相关蛋白质的水平极高,直接将其应用于血液样本具有挑战性。因此,有必要采取独特的策略,根据蛋白质在EV内的亚位置准确表征这些蛋白质。为克服这些障碍,研究人员建立了一个开创性的框架,称为EV单分子阵列(EV single-molecule array,eSimoa)。eSimoa是首次建立的,它基于三个互补且正交的流程,使得能够以异常的灵敏度和分辨率对EV蛋白质生物标志物进行空间解码。该框架将EV的分离与数字化、高通量的Simoa技术相结合,后者在基础科学和临床应用中被广泛认可和采用。Simoa以高灵敏度而闻名,能够在阿托摩尔(aM; 10的-18次方M)浓度下定量蛋白质,相对于现有方法的百万倍的提高。在Simoa中使用磁珠有助于轻松处理流体并使工作流程的自动化。eSimoa的第一个流程称为“表面eSimoa”,基于两个表面蛋白质生物标志物捕获和检测EVs。这种方法确保只有携带两种表面蛋白质的EVs被提交给Simoa分析。与表面eSimoa流程正交的是“腔室eSimoa”流程,专注于分析EV腔室蛋白质。第三个流程称为“表面-腔室eSimoa”,它整合了表面eSimoa和腔室eSimoa方法。在这个流程中,首先捕获具有特定表面蛋白质的EVs,然后使用腔室eSimoa流程分析这个有针对性的亚群体中的腔室蛋白质。eSimoa框架通过以异常的灵敏度提供EV蛋白质的空间分布的全面分析,重要的是,每个流程都可以直接应用于具有最小预纯化步骤的临床样本,使其在大规模临床研究中可行。为建立eSimoa框架,研究人员优化了多组Simoa测定,针对四个关键的蛋白标记进行了定位:CD81和CD63作为通用EV表面蛋白,RAS作为肿瘤相关蛋白,以及KRASG12D作为与胰腺导管腺癌(PDAC)相关的特异性蛋白。这些测定被用于分析从癌细胞培养物和人类血浆样本中获得的肿瘤源性EVs。通过利用创新的eSimoa框架,成功展示了解码EV表面和腔室蛋白的能力,同时准确量化腔室蛋白的绝对浓度。总体而言,eSimoa框架提供了一个有价值的工具,能够(1)在血浆中检测到极低浓度的EVs,(2)量化低至fM的绝对EV蛋白浓度,以及(3)解码EV蛋白的空间分布。eSimoa框架的推出标志着医学领域对于更准确、更可靠的疾病诊断工具的不断追求,为患者提供更早、更有效的治疗方案打开了新的大门。这一创新有望成为未来医疗实践的关键组成部分,为健康产业带来新的篇章。参考文献:Ultrasensitive and High-Resolution Protein Spatially Decoding Framework for Tumor Extracellular Vesicles. Adv Sci (Weinh). 2023 Nov 20:e2304926.
外泌体资讯网 Adv Sci丨超灵敏的肿瘤细胞外囊泡蛋白的空间分布检测