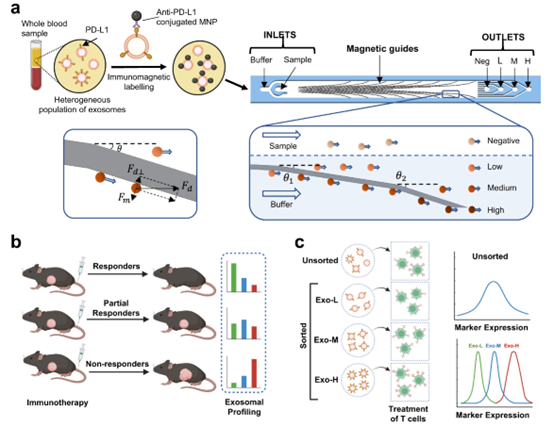
外泌体PD-L1 (exoPD-L1)作为一种预测PD-1/PD-L1免疫治疗反应的生物标志物,最近受到了广泛关注。然而,目前的外泌体分析技术主要依赖于总体测量,而不很难在各种外泌体亚群内发现的异质性。来自加拿大多伦多大学的研究人员提出了一个磁性激活的纳米级细胞检测平台NanoEPIC,可以从血浆中进行外泌体的分子分型和表面exoPD-L1表达分析。NanoEPIC提供了强大的、高通量的外泌体标记分析,使EV亚群分析成为可能,为增强癌症筛查、个性化治疗和治疗反应监测提供了新技术。相关内容以“A magneto-activated nanoscale cytometry platform for molecular profiling of small extracellular vesicles” 为题于9月11日在线发表在国际知名综合性学术期刊Nature Communications杂志上。
免疫检查点PD-L1的发现彻底改变了传统癌症治疗方法。干扰PD-L1/PD-1的干预措施改善了许多癌症的临床结果,包括肾癌、肺癌、乳腺癌、结肠癌和黑色素瘤。然而,由于肿瘤的异质性和免疫调节机制的复杂性,只有一小部分患者对免疫治疗有反应。因此,开发有效的诊断工具对患者进行分级,并使免疫治疗应答者和无应答者能够在早期分类,这将有助于早期决策,并最大限度地提高癌症治疗的成功率。虽然细胞表面PD-L1 (cPD-L1)是免疫治疗中最有效的预测性生物标志物之一,但它仅在不到30%的患者中被证明具有预测性。
最近的研究表明,与PD-L1相比,小细胞外囊泡(sEV)可以在其表面呈现PD-L1,并作为改进的信息性生物标志物。sEV是细胞外囊泡(EV)的一个亚类,是由细胞分泌的脂质双层封闭结构,其中外泌体是研究最多的sEV。sEV的典型尺寸范围为30-160 nm,可以携带来自亲本细胞的蛋白质、代谢物、脂质和核酸等分子成分,并在肿瘤微环境中充当通讯货物。由于其在血液、尿液和唾液等体液中的高稳定性和高丰度,sEV是有希望的癌症生物标志物。特别是,外泌体PD-L1 (exoPD-L1)已被证明是肿瘤进展和免疫治疗反应的一个强有力的指标。尽管分析外泌体标记物很重要,但由于肿瘤源性sEVs的体积小且异质性,检测起来存在许多技术限制。最近的研究表明,EV中的PD-L1表达可能是异质的,这些EV表现出PD-L1依赖性的T细胞活化抑制。
传统的分离sEV的方法,如超离心、过滤和聚合物沉淀法,耗时长,回收率和纯度低。此外,sEV分析的标准方法,如Western blot和酶联免疫吸附试验(ELISA),由于灵敏度相对较低、需要的样本量大而受到限制。一些研究尝试使用流式细胞术筛选外泌体蛋白。事实上,通过优化的高端细胞仪,PD-L1阳性EVs已在临床样本中被检测到,并显示出与免疫治疗结果相关。然而,对于尺寸小于100 nm的EV的检测仍然是一个挑战,需要提高通量。最近的研究已经应用新型纳米材料或微流体系统来检测sEV并分析其蛋白质含量。一些团队已经开发了几种能够对临床标本中的sEV进行多参数分析的平台,如纳米等离子体传感器、电化学传感器和免疫磁珠法。尽管这些方法具有出色的分析性能和广泛的诊断用途,但它们也缺乏处理大量血浆样品所需的通量。尽管我们对sEV的转化潜力的理解正在迅速发展,但如果缺乏基于其异质标记表达进行有效分离sEV的技术,进一步表征其在疾病中的生物学作用并将其作为临床生物标志物的能力将受到极大阻碍。
该研究团队近年来开发了许多基于免疫亲和的微流控技术,用于快速、高通量和廉价的靶向细胞生物标志物,以解决多种疾病的异质性。循环肿瘤细胞(CTC)的表面标记分析(如EpCAM)已显示出与癌症进展的临床相关性。他们还发现具有不同表面标记的细胞亚群表现出不同的行为。例如,与CD39高表达或低表达的肿瘤浸润淋巴细胞相比,CD39中等表达的肿瘤浸润淋巴细胞(TILs)在杀死癌细胞方面更有效。因此,研究团队认为,基于生物标志物的sEV分析也可以预测治疗结果。
在这项研究里,研究团队描述了一种微流控方法,通过使用免疫磁性激活细胞术(NanoEPIC),通过纳米级外泌体蛋白分选来分析sEV的分子谱。NanoEPIC平台可以基于表面标记物的表达对单个sEV进行高通量和高分辨率的分选。此外,NanoEPIC可以直接从无细胞的生物液体(如血浆或细胞培养基)中对sEV进行单步处理。通过小鼠模型,研究人员验证了NanoEPIC预测免疫治疗反应的可靠性,并证明了exoPD-L1谱与肿瘤PD-L1负荷和T细胞抑制之间的强烈关联。此外,sEV可以有效地回收用于下游分析,从而可以测试CD8+ T细胞的抑制作用。用表达不同水平PD-L1的sEV处理后,CD8+ T细胞的活化受到不同程度的抑制。总的来说,这种方法不仅可以对exoPD-L1进行表型分析,作为一种监测治疗反应的潜在策略,而且还可以分离异质sEV进行进一步的下游研究,为以sEV为重点的研究提供技术方法。
参考文献:A magneto-activated nanoscale cytometry platform for molecular profiling of small extracellular vesicles. Nat Commun. 2023 Sep 11;14(1):5576.