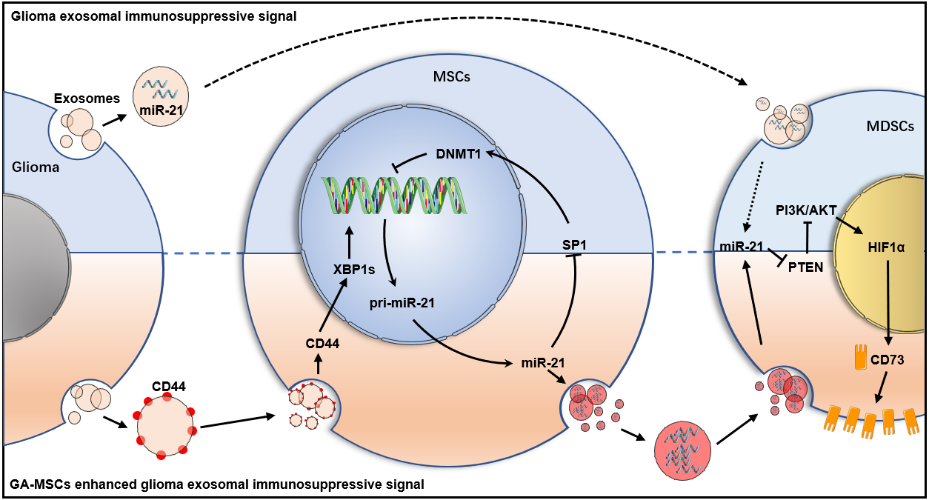
脑胶质瘤(Glioma)是成人中枢神经系统最常见的恶性肿瘤,手术及放化疗等传统的治疗方式效果差。由于胶质瘤独特的免疫抑制性微环境的存在,导致近年来兴起的在多种肿瘤中取得较好效果的抗PD-1等免疫治疗对胶质瘤的疗效有限。间充质干细胞(MSC)是一群具有自我更新和分化能力的多能干细胞,是胶质瘤微环境的重要组成成分,MSC在胶质瘤免疫抑制微环境的形成过程中发挥重要作用,但其机制尚不清楚。
近日,山东大学齐鲁医院李刚教授、薛皓副教授团队于Journal of Nanobiotechnology发表了题为“Mesenchymal stem cells, as glioma exosomal immunosuppressive signal multipliers, enhance MDSCs immunosuppressive activity through the miR-21/SP1/DNMT1 positive feedback loop”的研究论文(2023 Jul 22;21(1):233)。该研究发现胶质瘤微环境中的肿瘤相关间充质干细胞(Ta-MSC)能够作为信号放大器,放大胶质瘤外泌体的免疫抑制信号,通过增强髓系抑制细胞(MDSC)的免疫抑制能力促进胶质瘤恶性进展。齐鲁医院神经外科李刚教授和薛皓副教授为论文共同通讯作者,齐鲁医院神经外科医师邱伟为论文第一作者。
该研究发现胶质瘤相关MSC通过传递外泌体miR-21促进MDSC表达CD73,促进免疫抑制微环境的形成,这一过程与该团队前期研究中发现的胶质瘤外泌体直接传递miR-21增强MDSCs免疫抑制能力相似,但作用更强。进一步研究发现,胶质瘤来源的外泌体传递CD44蛋白促进MSC内质网应激,导致下游XBP1s蛋白含量升高,作为转录因子促进miR-21表达,而MSC中上调的miR-21又通过SP1/DNMT1通路降低miR-21启动子区域的DNA甲基化水平,通过正反馈环路进一步促进miR-21的高表达,导致MSC外泌体中的miR-21显著上调,增强MDSCs的免疫抑制能力以及促进胶质瘤恶性进展。此外,研究还发现使用改造后的树突状细胞DC来源的外泌体装载miR-21 inhibitor能够通过抑制MSC中的正反馈环路抑制免疫微环境的形成,并可与抗PD-1抗体联用抑制胶质瘤恶性进展。
参考文献:
Mesenchymal stem cells, as glioma exosomal immunosuppressive signal multipliers, enhance MDSCs immunosuppressive activity through the miR-21/SP1/DNMT1 positive feedback loop. J Nanobiotechnology. 2023 Jul 22;21(1)
外泌体资讯网 J Nanobiotechnology|山东大学齐鲁医院李刚/薛皓团队:肿瘤间充质干细胞诱导脑胶质瘤免疫耐受新机制