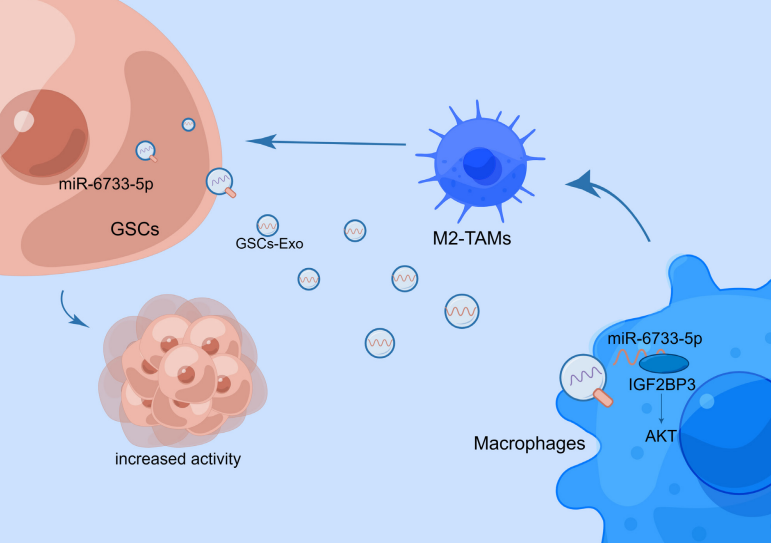
胶质母细胞瘤是中枢神经系统中最常见和最致命的癌症。胶质瘤干细胞(GSCs)重构的肿瘤微环境在胶质母细胞瘤发生及恶性进展中发挥着重要的作用。其中肿瘤相关巨噬细胞(TAMs)是除GSCs及其繁衍的胶质瘤细胞外占比最高的微环境细胞,约占肿瘤组织中全部细胞的5-15%。TAMs的极化对肿瘤的发展与转归发挥着重要的调节作用,而GSCs本身也可通过多种途径影响TAM的极化,二者相互作用,互相影响,共同重塑了一个肿瘤微环境。因此,深入了解GSCs与TAMs间的调控机制及关键靶分子,可为胶质瘤治疗新策略提供新思路。近日,苏州大学附属第二医院神经外科董军教授团队在CNS Neuroscience & Therapeutics(中科院一区)上发表了题为“Exosomal miR-6733-5p mediates cross-talk between glioblastoma stem cells and macrophages and promotes glioblastoma multiform progression synergistically”的文章(doi: 10.1111/cns.14296),该研究揭示了GSCs分泌的外泌体miR-6733-5p诱导巨噬细胞M2型极化,进一步提高了GSCs的自我更新能力和干性表达。苏州大学附属第二医院神经外科董军教授为文章的通讯作者。
外泌体是直径约100 nm的细胞外囊泡,富含包括非编码RNA、mRNA、DNA和小肽等分子,可传递给受体细胞,进行细胞间交流。来自肿瘤细胞的外泌体miRNAs已被发现可以通过重塑受体细胞的表型和功能来调节癌症的重要生物学特性,包括血管生成、免疫抑制和转移。为了探索GSCs外泌体miRNAs在巨噬细胞极化中的作用,研究人员首先通过间接共培养发现GSCs能促进巨噬细胞迁移能力增强并且向M2型转化。当加入外泌体抑制剂后,M2型巨噬细胞明显减少,随后研究人员成功提取并鉴定了GSCs分泌的外泌体,并加入到巨噬细胞中检测其极化。结果发现GSCs分泌外泌体可以使巨噬细胞向M2型极化。为了探究GSCs外泌体中发挥关键作用的特定miRNA,研究人员通过测序、生信分析和qPCR等实验发现miR-6733-5p在两株GSCs(GSC11与GSC23)及其分泌的外泌体中表达水平最高,而且在胶质母细胞瘤患者中标本中高表达,并递送至巨噬细胞,最终促使巨噬细胞向M2型极化。研究人员利用GSCs体外成球实验、干性标志物表达和体内实验评估了GSCs外泌体miR-6733-5p极化后的巨噬细胞对GSCs的影响。结果发现GSCs外泌体miR-6733-5p极化后的巨噬细胞极大地增强了GSCs的成球能力,提升了干性标志物表达,并且促进肿瘤进展。
(由Figdraw绘制)该研究确定了GSCs及其分泌的外泌体能诱导巨噬细胞M2型极化,极化后的M2巨噬细胞进一步提高了GSCs的自我更新能力和干性表达。鉴于外泌体已被证明可以运输miRNAs调控受体细胞功能,研究发现miR-6733-5p在胶质母细胞瘤患者的手术标本中富集,在GSCs衍生的外泌体中高度表达,并通过外泌体递送至巨噬细胞靶向IGF2BP3激活AKT信号通路从而介导M2型巨噬细胞的极化。这些数据表明,GSCs产生富含miR-6733-5p的外泌体,诱导巨噬细胞的M2型极化,以增强GSCs的干性并促进肿瘤的恶性进展。靶向外泌体miR-6733-5p可能提供一个潜在的对抗胶质母细胞瘤的新策略。参考文献:Exosomal miR-6733-5p mediates cross-talk between glioblastoma stem cells and macrophages and promotes glioblastoma multiform progression synergistically. CNS Neurosci Ther.2023; doi:10.1111/cns.14296.