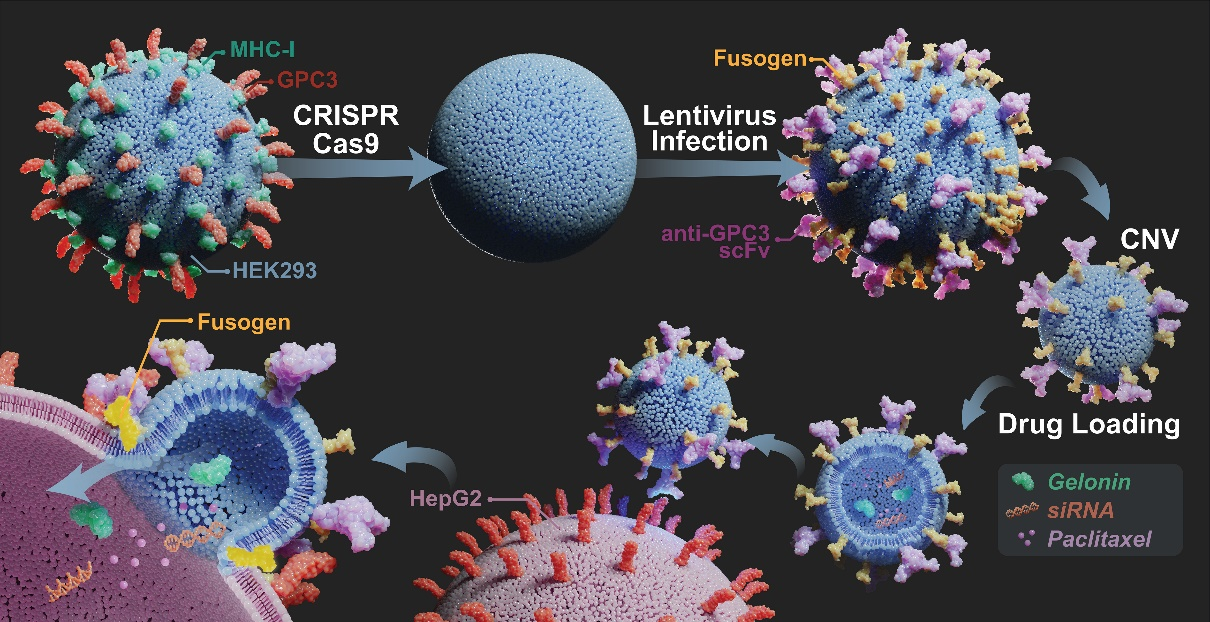
胞外囊泡(EV)是细胞释放的亚微米大小的囊泡。它可在细胞间传递蛋白、核酸等,从而介导细胞间通信。EV可作为药物的天然载体,用于药物递送。与合成的纳米药物载体相比,EV能够逃避机体免疫系统的吞噬清除,具有良好的生物相容性,因而有广阔的应用前景。但EV载药存在靶向能力不足、胞质递药低效,且有EV产量低、制剂批次差异性大等不足,导致其临床转化困难。纽州立宾汉姆顿大学万源教授团队前期研究发现,通过物理挤压细胞技术获得的纳米囊泡(CNV)可做为天然EV的替代。供体细胞经机械性挤压制备CNV的生产效率是EV的50-100倍,而生产成本不到EV的10%。该团队近期研究还发现CNV和EV的膜蛋白近似度超过70%,且CNV的批间变异可以限制在10%以内。以上研究提示CNV可作为EV替代品用于药物载体。在解决产量、生产成本、制剂质控后,如何提高CNV的靶向能力及胞质内药物递送效率就变得更为迫切。万源教授团队联想到了病毒的基本技能,即靶向性和胞浆内物质递送。病毒特异性识别、结合细胞表面靶分子后,通过其膜融合蛋白促使受体细胞膜和病毒膜发生融合,从而将病毒的核酸、蛋白直接注入胞浆。本研究中,该团队开发了对病毒进行仿生的CNV,即eFT-CNV(effective CNV)。研究人员先用CRISPR/CAS9将MHC-I和GPC3从HEK293细胞膜上敲除。MHC-I会递呈母细胞异常抗原,招致巨噬细胞的吞噬,敲除MHC-I可降低CNV的免疫原性。为避免因后续在细胞表面表达抗GPC3的scFV而产生CNV自聚体现象,导致可能的eFT-CNV收集失败,故敲除GPC3。进一步,用慢病毒感染细胞,使其依次表达抗GPC3的scFv和工程化的病毒膜融合蛋白。需注意的是,该工程化的膜融合蛋白不具备和靶分子结合的能力,但保留了促膜融合能力。其后,物理性挤压构建成功的HEK293细胞收获eFT-CNV。eFT-CNV通过抗GPC3的scFv结合至GPC3高表达肿瘤细胞表面,再由膜融合蛋白促发膜融合,从而完成肿瘤细胞胞浆内递药(图1-3)。
图1:eFT-CNV制备
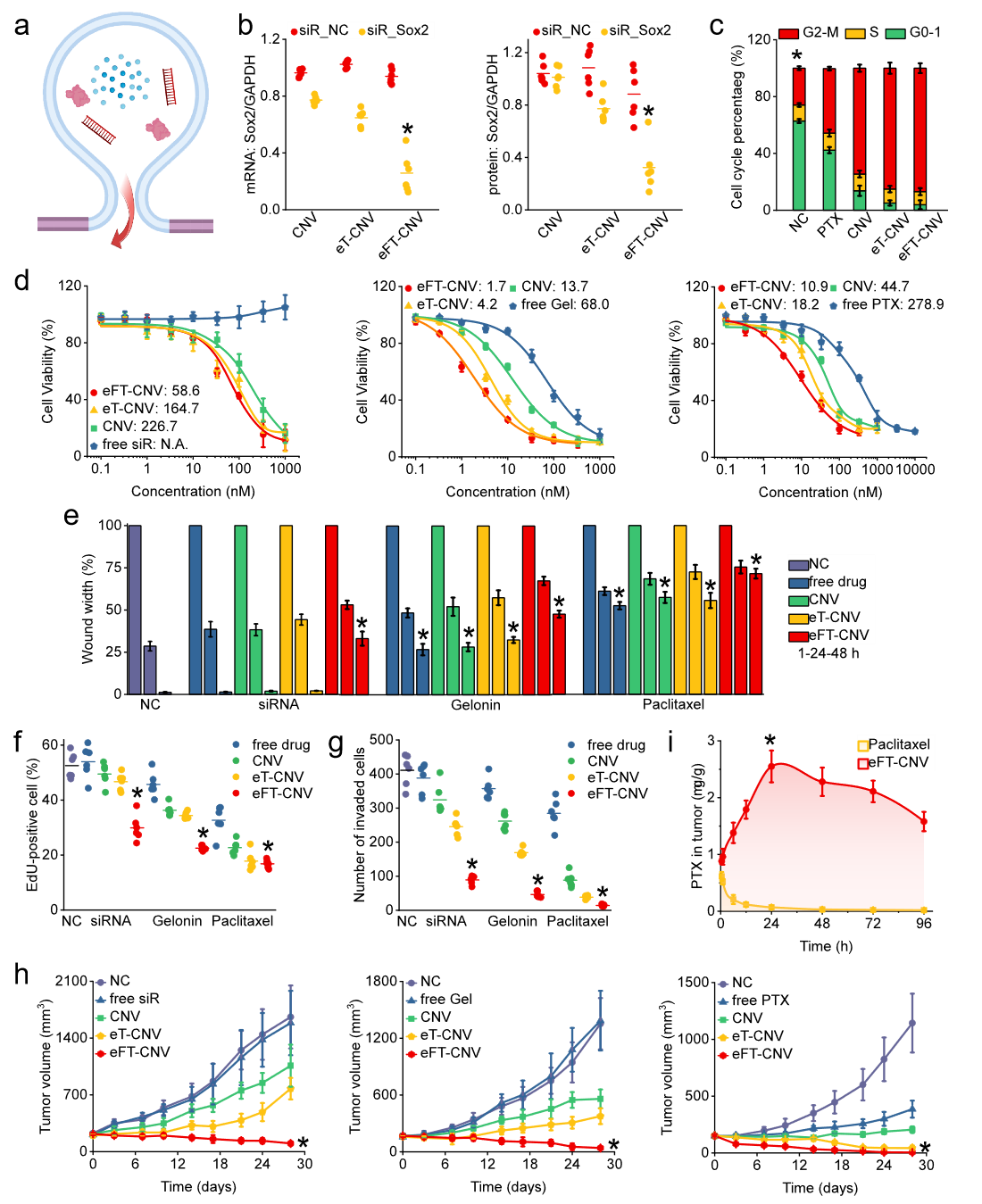
图2:HEK293细胞改造及表征体外体内实验表明,eFT-CNV因可以直接将药物递送到胞浆,所以呈现了更好的治疗效果(图4),并能够有效递送多种药物,如干扰RNA、毒性蛋白及小分子药物,其功效在递送毒性蛋白实验中尤为明显。Gelonin是疏水性毒性蛋白,几乎不能自发穿透细胞质膜,无法与胞浆内蛋白结合,难以实现抑制RNA合成诱导细胞死亡,故其在肿瘤治疗中效果有限。但Gelonin被装载到eFT-CNV后,eFT-CNV可有效地将其递送到GPC3高表达的肿瘤细胞浆内,显著提高了对肿瘤细胞的杀伤作用。除了具备优异的药物递送功能, eFT-CNV还有其它更广阔的应用前景。例如,将特定新抗原通过膜融合的方式锚定到免疫冷肿瘤细胞膜表面,将其转化为免疫热肿瘤,从而促进免疫细胞介导的肿瘤杀伤。装载有CRISPR/Cas9复合物的eFT-CNV,则可更为高效地完成对特定细胞的基因编辑。与脂质纳米颗粒相比,低免疫原性的负载mRNA的eFT-CNVs能高效地将mRNA传递到细胞质中,提示了eFT-CNVs的设计思路可作为新一代疫苗载体及原位CAR-T生产的有效技术参考。综上,仿生病毒细胞纳米囊泡eFT-CNV可成为纳米医学和精准医学中的一个有较好价值和潜力的科学工具。原文链接:https://doi.org/10.1038/s41467-023-39181-2
图3:eFT-CNV的基本表征
图4:体外体内实验证明eFT-CNV有更好的治疗效果