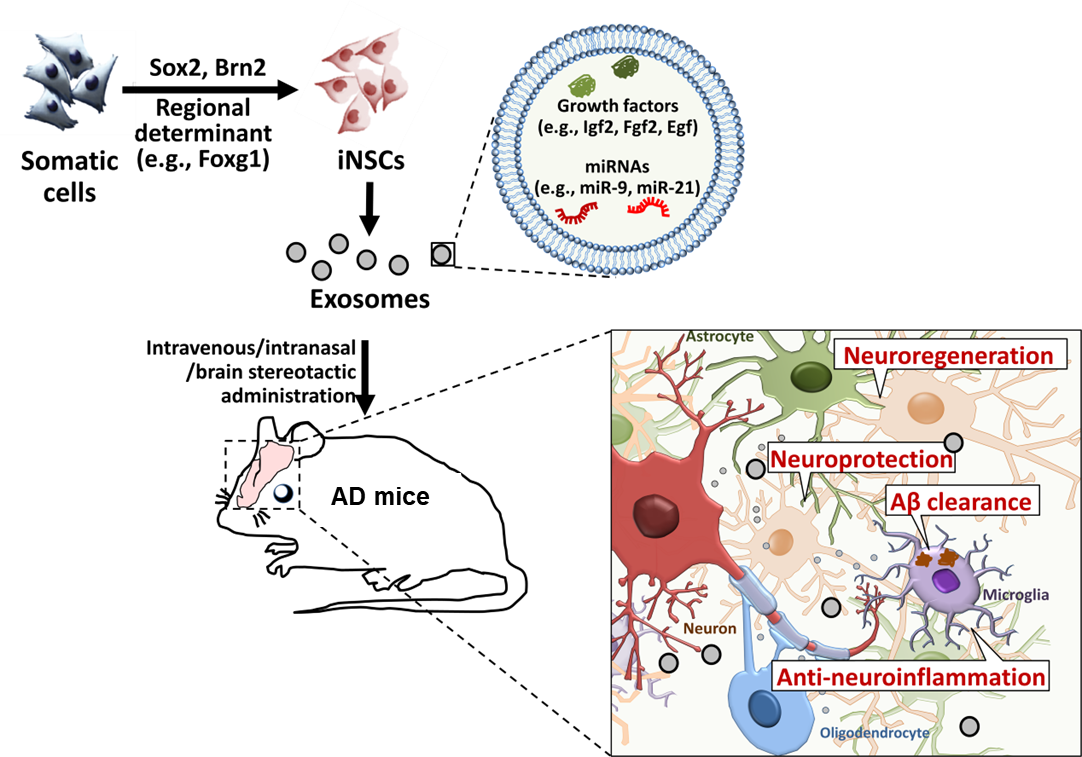
阿尔茨海默病(Alzheimer’s disease,AD)是最常见的神经退行性疾病,目前没有有效的治疗手段。大量研究发现干细胞来源的细胞外囊泡(extracellular vesicles,EVs)具有成为AD全新治疗策略的光明前景。EVs作为细胞释放的小膜泡,具有血脑屏障穿透能力,可通过外周给药进入中枢神经系统。更重要的是,干细胞来源EV可继承干细胞中具治疗潜能的分子,通过将这些分子传递给脑内细胞起到与干细胞脑内移植类似的神经疾病治疗效果。目前,神经疾病治疗领域的体外和动物实验中,神经干细胞(neural stem cells,NSCs)和间充质干细胞(mesenchymal stem cells,MSCs)是最常见的EV来源干细胞。缺血性脑卒中模型小鼠研究表明,NSC来源EVs(NSC-EVs)具有比MSCs来源EVs(MSC-EVs)更好急性神经损伤修复中比MSC衍生的EVs表现出更好的效果潜能。然而,由于伦理/宗教问题、供应限制、潜在免疫反应、遗传/表型不稳定等诸多问题,NSCs作为临床级EVs的细胞来源尚存在一定争议。通过体细胞重编程技术获得了诱导性NSCs(induced NSC,iNSCs)有效规避了上述问题,但是iNSCs来源EVs(iNSC-EVs)是否可以在AD治疗中作为NSC-EVs的合格的替代品仍不清楚。近日,同济大学附属同济医院郑加麟教授、夏骁寰研究员和同济大学附属养智康复医院王奕副教授在Signal Transduct Target Ther杂志(IF: 38)在线发表了题为“Neural stem cell-derived extracellular vesicles mitigate Alzheimer's disease-like phenotypes in a preclinical mouse model”的研究论文(2023 Jun 14;8(1):228)。该工作报道了iNSC-EVs对于AD模型小鼠认知功能障碍和AD相关病理指标的短期和长期改善效果,揭示了iNSC-EVs通过传递miRNA抑制神经炎症从而改善AD行为与病理表型的分子作用机制,表明iNSC-EVs是一种优于MSC-EVs的潜在AD治疗药物。

在这项工作中,研究人员通过小动物活体成像、免疫染色等实验确认尾静脉注射给药后5分钟EV即可进入中枢神经系统并被各类脑细胞所摄取。随后研究人员对AD模型小鼠(5×FAD)进行了为期1个月的给药(10次),通过浓度梯度实验确认150 μg/次的最佳给药剂量。研究人员进一步发现NSC-EVs和iNSC-EVs给药均可以有效缩短5×FAD小鼠在水迷宫中找到平台时间并增加在平台象限停留时间和运动距离,增加5×FAD小鼠在Y迷宫中进入新臂的频次,提高5×FAD小鼠识别新物体的能力,表明NSC-EVs和iNSC-EVs给药有效改善5×FAD小鼠认知功能。NSC-EVs和iNSC-EVs给药还可以有效降低5×FAD小鼠脑内Aβ和pTau积累水平、抑制神经元损伤、降低小胶质细胞驱动的神经炎症水平,表明NSC-EVs和iNSC-EVs给药可显著改善AD经典的病理指标。更重要的是,iNSC-EVs给药一个月后依然可有效改善AD行为与病理表型,且iNSC-EVs具有比MSC-EVs更好的改善效果。研究人员发现NSC-EVs和iNSC-EVs给药后主要被脑内小胶质细胞所摄取。RNA测序结果显示NSC-EVs和iNSC-EVs给药后脑内炎症反应相关基因表达和信号通路活性受到显著抑制,体外实验证实EVs有效改善Aβ刺激引起的小胶质细胞炎症反应。miRNA测序结果显示iNSC-EVs中高度富集let-7、miR-9、miR-21、miR-106等miRNA,生物信息学分析分析EVs富集miRNA可靶向AD神经炎症相关基因。通过敲低EVs中相关miRNA的表达水平发现iNSC-EVs主要通过传递let-7和miR-21抑制AD神经炎症相关基因表达,揭示miRNA在介导iNSC-EVs神经免疫调控中的重要作用。同济大学医学院郑加麟教授、夏骁寰研究员、王奕副教授为本文共同通讯作者,高歌助理教授、李聪聪助理研究员、博士后马艺钊和博士生梁占平为共同第一作者,博士生李云、李乡雨、傅声扬等为本研究做出了重要贡献。该项工作得到了国家自然科学基金委等项目的重要支持。
参考文献:Neural stem cell-derived extracellular vesicles mitigate Alzheimer's disease-like phenotypes in a preclinical mouse model, Signal Transduct Target Ther. 2023 Jun 14;8(1):228. doi: 10.1038/s41392-023-01436-1. 原文链接:https://www.nature.com/articles/s41392-023-01436-1