对肿瘤的无创诊断一直是临床早期治疗、个性化治疗、治疗预后检查中的理想化方案。目前,已经十分明确的是对肿瘤的实时监测是实现精准治疗的关键手段。现阶段,基于组织学检查的病理检测依然是临床肿瘤诊断的金标准,但这种样本获取方式是侵入性的,且难以进行多次重复检测,在患者确诊后不适用于长期的肿瘤监测。影像学一直以来都承担着人群肿瘤早筛和预后监测的功能,然而影像学仍然存在高假阳性和辐射暴露风险等问题,以CT和B超为代表的影响学检查依然不适合作为对肿瘤持续监测的手段。
为了进一步完善癌症患者病情进展的监测方式以及提高对癌症早筛的效率,研究者们开始探索对肿瘤组织或细胞样本的无创获取方式与检测新途径。基于血液标志物的早期检测方法因无创、操作方便、适用于广泛筛查等优势被寄予厚望。在肿瘤组织的进展过程中,有部分细胞和分泌物会被释放至体液当中,这些物质往往能反映其来源细胞的生理特征。在此基础上,针对循环肿瘤细胞、循环肿瘤DNA和肿瘤细胞外囊泡的检测得到了快速发展并被总结归纳为针对肿瘤组织的液体活检技术。相对于传统的组织活检,液体活检是指通过无创或微创方式获取肿瘤患者的体液,获得其来源肿瘤组织的相关生物信息。其中肿瘤细胞外囊泡(Tumor Extracellular Vesicle,TEV)是液体活检领域发展最迅速的方向之一。TEV可以通过血液、淋巴等体液系统将相应的生物信息传递到远端的组织和器官,从而实现细胞间的远距离通讯,进而影响肿瘤的进展或转移等。因此,基于TEV的生物学特性、细胞调控功能及其对肿瘤进展的影响,在临床中开发针对肿瘤液体活检的EV体外快速诊断技术对于深入了解肿瘤发病机制、研究肿瘤耐药性机制等方面具有重要意义。
侧向免疫层析(Lateral Flow Immunoassay,LFIA)是目前体外诊断中应用最广泛的方法,其具有低成本、操作简单、无需配合大型仪器等显著优势。而且,LFIA便捷的操作和简单的结果判读方式对用户十分友好,在基层或偏远地区的临床诊断中也可得到充分利用,非常适合用于对疾病的大规模筛查。目前,已有多个研究团队针对EV体外诊断开发了LFIA方法。现有EV LFIA检测试纸在检测性能及检测准确性均展现出一定优势,但在检测过程中LFIA系统受血浆、唾液、尿液等体液基质影响较大,使用的EV均需要预先分离纯化操作,而基于超速离心的EV分离步骤根据实验条件要求,需要3-10小时的操作时间,复杂的预处理步骤很大程度限制了该方法在临床上的推广应用。因此,研发一种适配LFIA检测平台的新型EV快速分离方法,将极大地简化LFIA检测预处理步骤,有助于EV LFIA在临床肺癌筛查的应用。
近日,暨南大学唐勇教授团队联合广东省第二人民医院曹东林主任团队在ACS Sensors在线发表了题为“Rapid Evaluation of Lung Adenocarcinoma Progression by Detecting Plasma Extracellular Vesicles with Lateral Flow Immunoassays”的研究论文(DOI:10.1021/acssensors.2c02706)。文章通讯作者为暨南大学生命科学技术学院唐勇教授、广东省第二人民医院检验医学部曹东林主任和广东省第二人民医院检验医学部肖威博士,第一作者为暨南大学生命科学技术学院在读博士研究生路程和广东省第二人民医院检验医学部在读硕士研究生苏艳琼。
研究首先选取了具有时间分辨荧光的铕荧光微球,提高系统的整体检测信号,并且选取EV相关标志蛋白(CD81、CD9)作为EV-LFIA检测靶标,以双抗体夹心原理构建针EV-LIFA。由于90%以上的EV颗粒中都表达上述相关标志蛋白,因此在检测中以CD81+与CD9+的颗粒数表示总EV的颗粒数。同时使EV-LFIA系统可以直接使用血浆进行测试,在构建过程中需要通过细致地条件优化,最大程度地减少血浆基质对EV-LFIA系统正常运行的影响。由于以往相关研究只验证了使用LIFA系统检测EV的可行性,未深入进行临床对比分析研究。因此,该工作在构建EV-LFIA基础上,收集临床肺癌患者血浆与健康供体血浆,进行EV-LFIA对比测试,分析EV-LFIA在临床肺癌诊断中的应用潜力。
为了进一步检测血浆中肿瘤细胞来源的EV(TEV),在EV-LFIA的构建基础上建立针对TEV的LFIA检测系统(TEV)。研究选取一个肿瘤相关标志蛋白(EpCAM)与一个EV标志蛋白(CD81)作为TEV-LFIA检测靶标,以双抗体夹心原理构建TEV-LFIA。EpCAM是最早确认的肿瘤标志蛋白之一,通常会在转移性、侵袭性肿瘤细胞中高表达,以作为分选CTC的标志蛋白之一,且EpCAM+ EV具有促进肿瘤细胞迁移与肿瘤组织进展的能力。因此在测试中以EpCAM+与CD81+的颗粒数表示TEV的颗粒数。为了探究TEV-LFIA在临床中对肺癌患者肿瘤进展的监测效果,文中调查了30名肺癌患者入院化疗期间阶段性化疗前后的CT检查结果,收集了患者化疗后进行CT检查当天的血浆样本,用血浆样本运行TEV-LFIA测试。根据CT报告结果将患者分为肺影增大组、肺影不变组与肺影缩小组。以TEV-LFIA结果与CT检测报告进行分组比对,以分析TEV-LFIA作为肺癌监测方法在临床中的应用潜力。
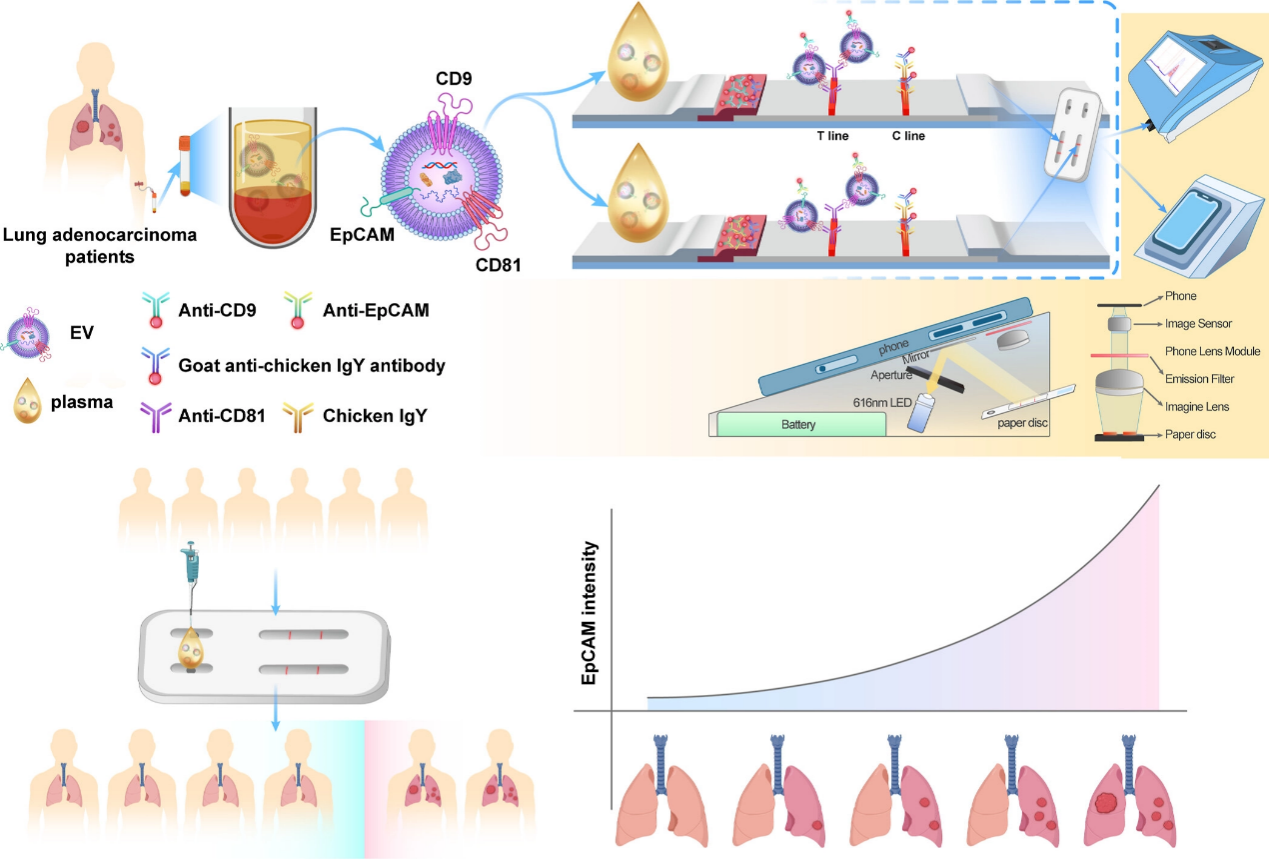 图1 EV-LFIA和TEV-LFIA检测试纸的原理图及应用场景
图1 EV-LFIA和TEV-LFIA检测试纸的原理图及应用场景
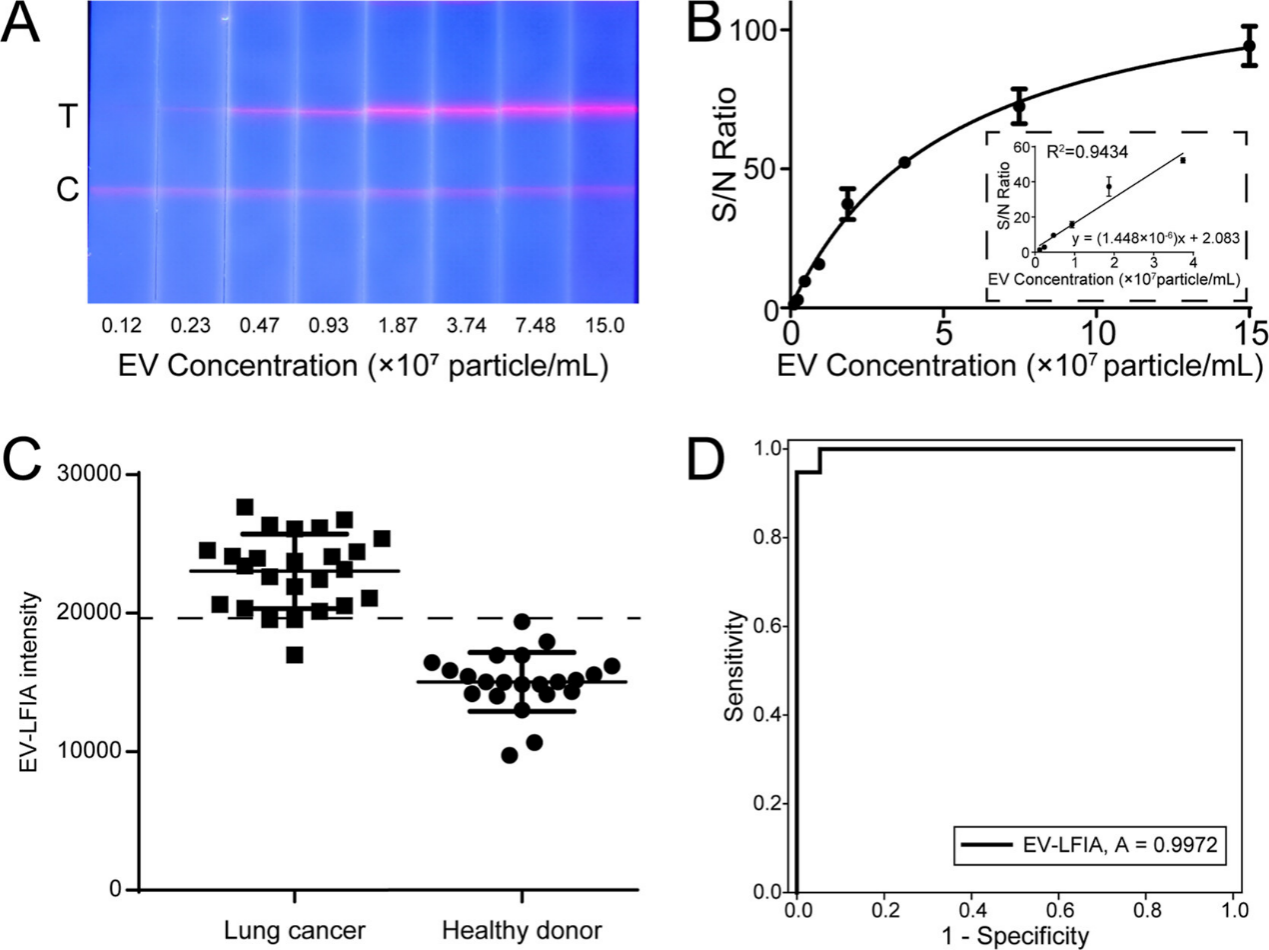
研究使用从A549细胞系提取的EV对EV-LFIA进行分析测试性能验证。利用干式免疫荧光分析仪对运行后的EV-LFIA T线信号进行量化分析。结果显示EV-LFIA对EV的检测线性范围在0.12-3.74×107/mL,LoD为2.4×105/mL。并且通过对构建参数的优化,EV-LFIA可直接对血浆样本中的EV进行检测。为了评价EV-LFIA在临床使用中的效果,本研究采集了25名肺癌患者和22名健康供体血浆,并用EV-LFIA进行测试。结果显示对肺癌患者血浆的EV-LFIA检测信号显著高于健康供体血检,其对肺癌诊断的ROC曲线下面积为0.9972,灵敏度和特异性相较于传统肿瘤标志物有明显提升。
(A)EV-LFIA测试不同浓度EV时的图像记录;(B)EV-LFIA检测的线性范围;(C)使用EV-LFIA对22例健康供体血浆与25例肺癌患者血浆检测的信号值;(D)使用EV-LFIA对47例样本进行肺癌诊断的ROC曲线分析
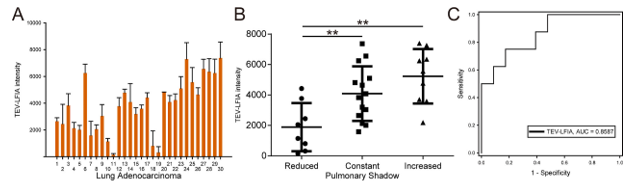
此外,为了测试TEV-LFIA对肺癌患者的监测能力,研究入组了30例肺腺癌患者,使用TEV-LFIA检测患者血浆,并且查询了入组患者在此治疗期间前后的CT检查报告。根据CT报告将患者分为了肺影缩小组、肺影不变组和肺影增大组,其中认为肺影不变和肺影增大患者对该阶段治疗无反应,肺影缩小组的患者对该阶段治疗有反应。根据检测结果,三组肺腺癌患者的TEV-LFIA检测信号值有显著差异。
(A)30例肺腺癌患者血浆的TEV-LFIA检测信号值;(B)具有不同CT检查结果患者的TEV-LFIA检测散点图;(C)使用TEV-LFIA用于肺腺癌治疗效果判断的ROC曲线分析
总而言之,这项研究开发了两种基于LFIA平台的EV检测试纸(EV-LFIA和TEV-LFIA),可以直接检测血浆中的特定EV。EV-LFIA的LoD可达2.4×105/mL,并能有效区分肺癌患者血浆与健康供体血浆。此外,TEV-LFIA的检测信号与CT结果进行了对比,发现TEV-LFIA检测信号较高的患者肺影也具有增大的趋势,为临床肺癌监测提供了一种潜在的参考指标。
参考文献:
Rapid Evaluation of Lung Adenocarcinoma Progression by Detecting Plasma Extracellular Vesicles with Lateral Flow Immunoassays, ACS Sens. 2023 May 17. doi: 10.1021/acssensors.2c02706.