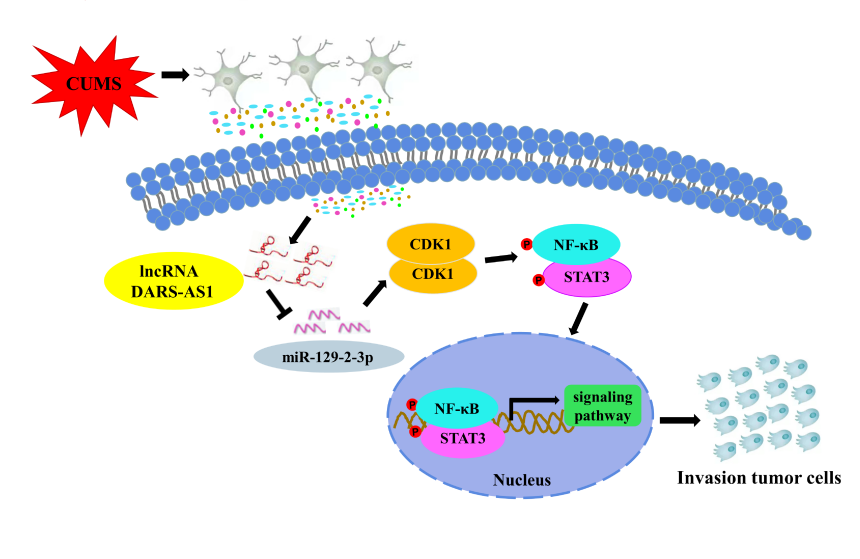
侵袭转移是导致临床三阴性乳腺癌(triple-negative breast cancer,TNBC)患者高死亡率的主要原因。机体长期慢性应激(chronic predictive mild stress,CUMS)可通过调控神经内分泌系统而改变机体内稳态,并诱导恶性肿瘤的发生发展和侵袭转移。然而,目前有关CUMS对TNBC发生发展和侵袭转移的影响及其作用机制仍不清楚。近日,西北工业大学生命学院尹大川教授团队在国际著名期刊Cancer Letters上发表了题为“Exosomes deliver lncRNA DARS-AS1 siRNA to inhibit chronic unpredictable mild stress-induced TNBC metastasis”的研究论文(doi: 10.1016/j.canlet.2022.215781)。该研究发现,CUMS状态可诱导lncRNA DARS-AS1高表达,进而促进三阴性乳腺癌(TNBC)的侵袭转移,研究人员采用外泌体(exosome,EXOs)递送DARS-AS1 siRNA,通过阻断NF-κB/STAT3信号通路抑制TNBC的体内成瘤和肝转移。
该研究通过构建TNBC原位异种移植瘤模型并对荷瘤小鼠进行了CUMS模型干预;随后采用瘤内注射DARS-AS1 siRNA负载的EXOs递药系统,观测其对CUMS模型诱导的TNBC体内成瘤和转移的影响。结果表明,在采用瘤内注射DARS-AS1 siRNA负载的EXOs递药系统治疗CUMS诱导的TNBC异种移植瘤裸鼠模型时,DARS-AS1可作为miR-129-2-3p的分子海绵,进而上调CDK1的表达并激活下游NF-κB/STAT3信号通路,促进TNBC的增殖和肝转移。研究人员随后使用该信号通路特异性抑制剂EVP4593在细胞和组织水平验证了此现象。该研究成果有望为临床转移性TNBC的治疗提供新靶点和一种高效、安全的药物载体。
图1. CUMS介导的lncRNA DARS-AS1促进TNBC侵袭转移示意图该项目研究得到了国家自然科学基金、陕西省重点研发计划、陕西省创新人才推进计划-科技创新团队、中国博士后科学基金和西北工业大学博士学位论文创新基金支持。西北工业大学生命学院为第一单位,博士研究生刘新利为本论文的第一作者,张辰艳副教授、尹大川教授和吉林大学赵刚副主任医师为本论文通讯作者。参考文献:Exosomes deliver lncRNA DARS-AS1 siRNA to inhibit chronic unpredictable mild stress-induced TNBC metastasis. Cancer Lett. 2022; 215781. doi: 10.1016/j.canlet.2022.215781.
外泌体资讯网 Cancer Lett |西北工业大学尹大川团队发现外泌体递送DARS-AS1 siRNA可用于抑制慢性应激诱导的乳腺癌侵袭转移