管钙化(vascular calcification, VC)是一种区别于动脉粥样硬化的血管性疾病,主要特征是血管壁出现异位钙磷沉积,在糖尿病、慢性肾脏疾病和衰老患者中最常见。血管钙化损伤和持续炎症过程会刺激血管壁重塑,引起血管硬度增加,舒张型心力衰竭,高血流灌注器官灌注减少,慢性肢体缺血等并发症。早期人们认为血管钙化是继发于体内钙磷代谢失调的被动过程,但随着科学研究的不断深入,越来越多的证据表明血管钙化是一个主动的,可调控的,动态的,与骨形成非常相似的病理过程,而外泌体作为细胞间通讯的重要工具,在这当中发挥着十分重要的作用。
近日,中南大学湘雅二医院代谢内分泌科袁凌青课题组在Front Cardiovasc Med(影响因子:6.684)发表了题为“Cellular Crosstalk in the Vascular Wall Microenvironment: The Role of Exosomes in Vascular Calcification”的综述(2022 May 23;9:912358),博士生吴芸芸和单素康为论文的第一作者,袁凌青教授为论文的通讯作者。
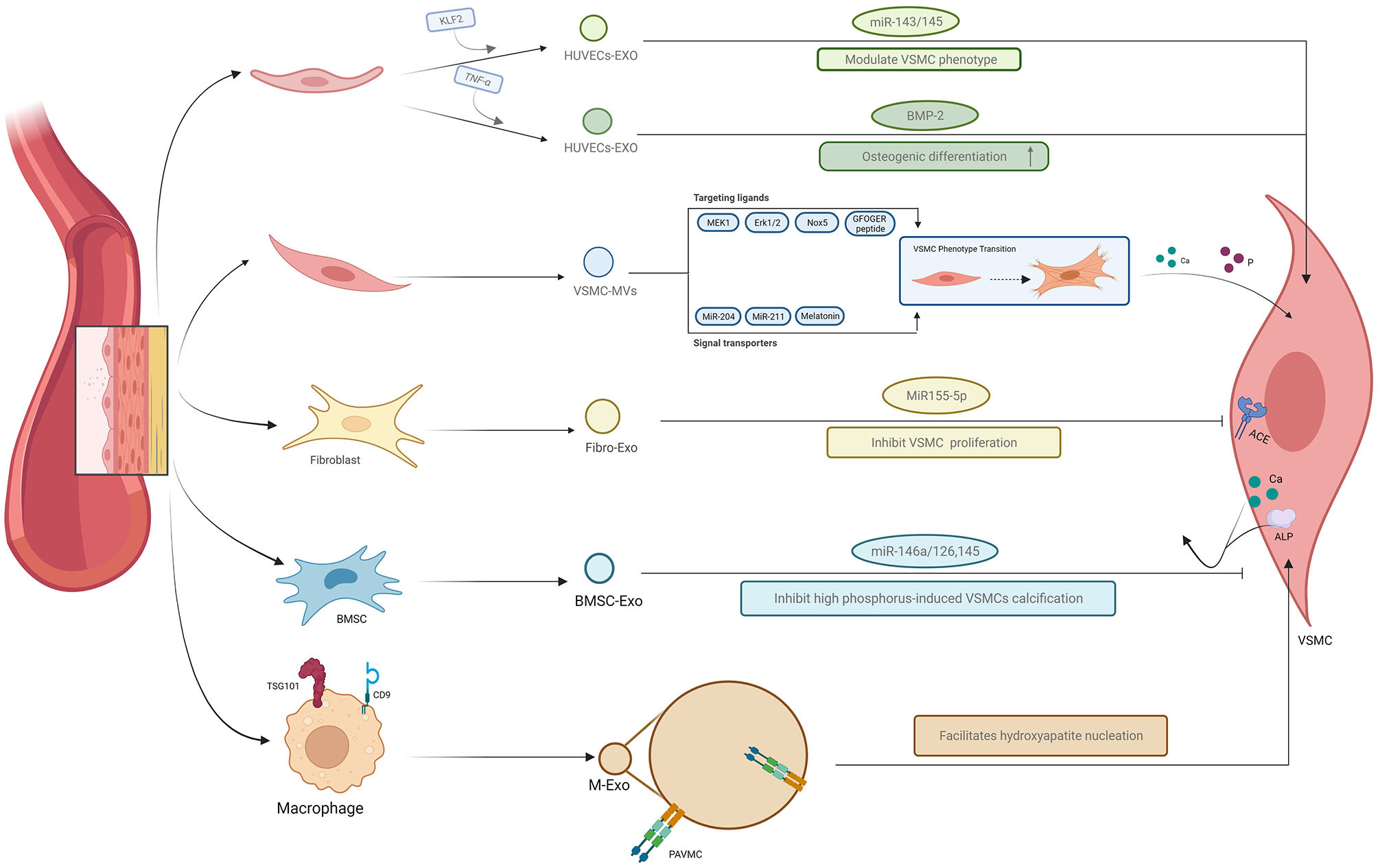
血管壁从管腔面向外依次分为内膜、中膜和外膜,分别主要由内皮细胞、血管平滑绩细胞和血管成纤维细胞构成。该综述总结了不同血管壁细胞之间通过细胞外囊泡的相互作用,发现血管壁不仅是保障血流运行的物理屏障,还是一个能相互crosstalk的有机整体,不同的血管壁细胞之间能够相互对话,共同维持血管壁的生理平衡,因此根据课题组自己的研究及最新的进展,袁凌青课题组提出“血管壁微环境学说”,即在由血管壁构成的完整微环境中,血管壁细胞通过分泌细胞外囊泡进行crosstalk,能够调控血管钙化。最新研究表明,脂多糖(LPS-EK)处理的巨噬细胞分泌的外泌体可以在VSMC中介导炎症和氧化应激,从而促进血管钙化的进展。此外,骨髓间充质干细胞衍生的外泌体(BMSC-Exo)通过递送miR-381-3p在慢性肾衰中起到抗钙化效应。在这篇综述中,作者总结了血管内皮细胞,血管平滑肌细胞,血管外膜成纤维细胞,间充质干细胞,巨噬细胞等细胞在血管壁微环境中的相互crosstalk,其中部分外泌体通过减少VSMC表型转化和内皮——间充质转变来发挥抗钙化作用,从而抑制羟基磷灰石矿物质的沉积。抑钙化作用主要由miR-29b,miR-30b / c,miR-125b,miR-34b / c,miR-135a和miR-712等功能性miRNA介导。
图1血管微环境中的细胞群及其在血管钙化中的作用
图2外泌体介导的血管微环境中细胞间的“对话”
因此,作者认为血管壁是一个具有丰富调节功能的微环境,它能够协调血管壁细胞和其他细胞间的相互对话,为全面认识血管壁功能,阐明血管钙化的机制和挖掘未来治疗方向开辟了新思路。
参考文献:
Cellular Crosstalk in the Vascular Wall Microenvironment: The Role of Exosomes in Vascular Calcification. Front Cardiovasc Med. 2022 May 23;9:912358.