肝细胞癌(Hepatocellular Carcinoma,HCC)是全球癌症相关死亡的主要原因。研究发现细胞外囊泡(Extracellular Vesicles,EVs)含有丰富的生物活性内容物,是细胞间信息交换的载体,显示出治疗HCC的巨大潜力。EVs可以改变受体细胞的功能,从而在HCC的发生、发展和发病机制中发挥重要作用。
近日,来自西南医科大学临床医学院的韩云炜教授团队的研究人员在Frontiers in Oncology杂志上发表题为“Extracellular Vesicles and Hepatocellular Carcinoma: Opportunities and Challenges”的综述(2022 May 25;12:884369),重点介绍了EVs的生物发生、形态特征、分离提取以及不同细胞来源的EVs在HCC的生物发展、肿瘤侵袭、免疫逃逸和癌症治疗中的意义。EVs可能成为HCC分子诊断的有效生物标志物和肿瘤靶向治疗的新靶点。
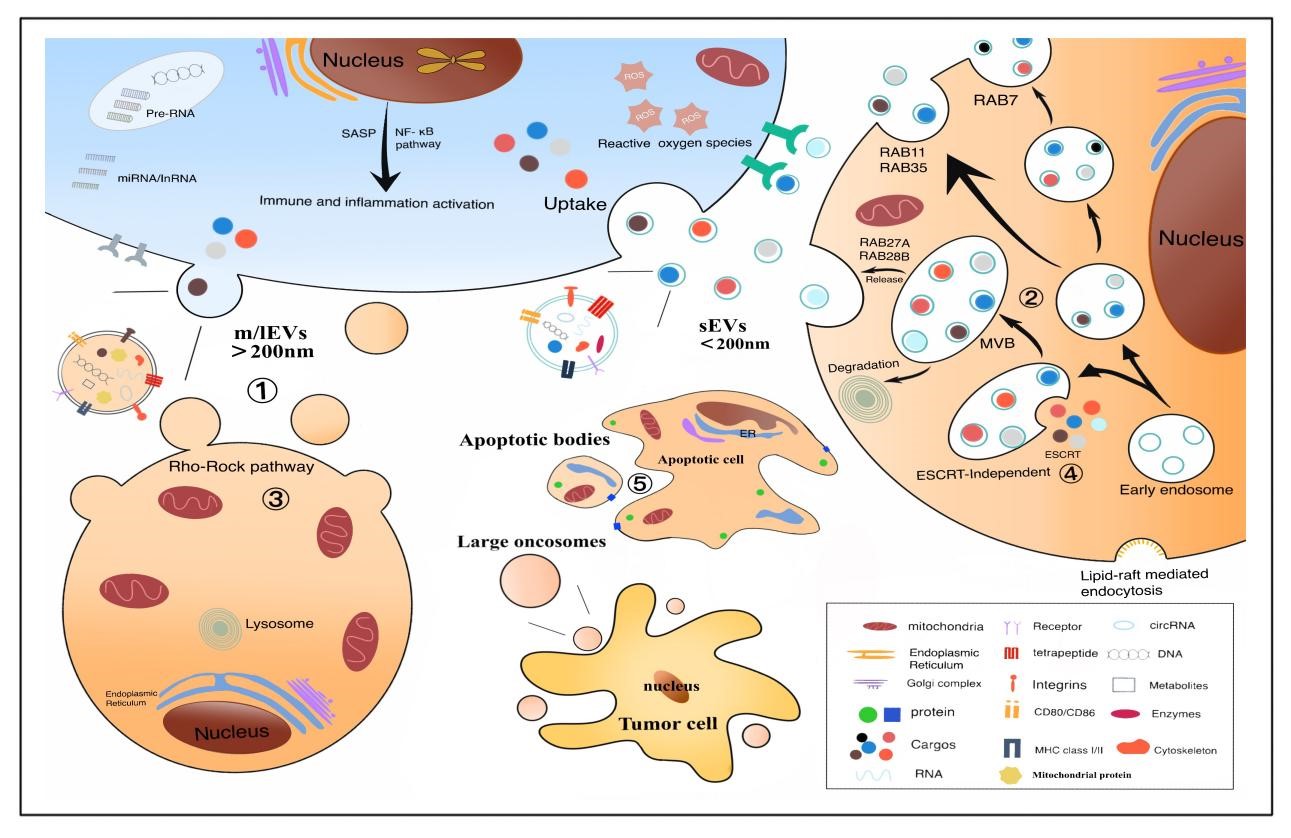
EVs 可以在具有各种细胞释放膜结构亚型的人类生理和病理疾病中发挥关键作用。粒径<200 nm 的 EV 称为小 EV (sEV),直径 >200 nm 的中到大颗粒称为m/lEV (Medium/large EV)。根据描述和来源,又可分为凋亡小体、大肿瘤体、缺氧EVs和足细胞等。
图1. EVs的生物发生和种类
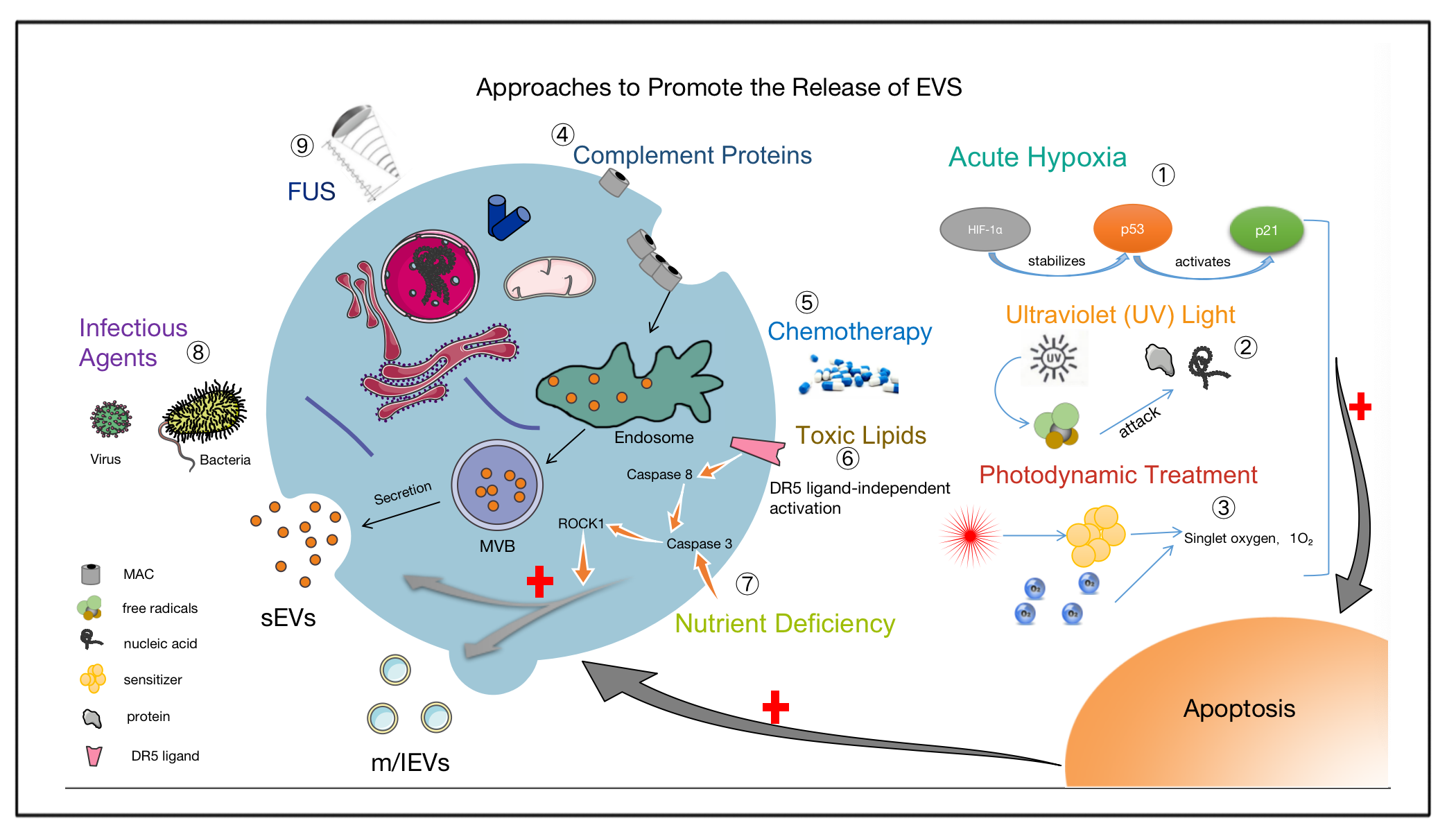
EVs的分离、富集和定量是生物医学研究以及临床转化的必要条件。在不同的条件下,选用合适的分离方法显得尤为重要。改进现有的EVs分离、纯化和储存技术,使其更好地应用于临床一直是研究人员面临的巨大挑战。作者认为为了有效地获取EVs,除了采用合适的分离技术外,各种物理、生物、化学刺激因素在促进EVs的产生和释放方面也显示出巨大潜力。
图2. 促进EVs释放的方法
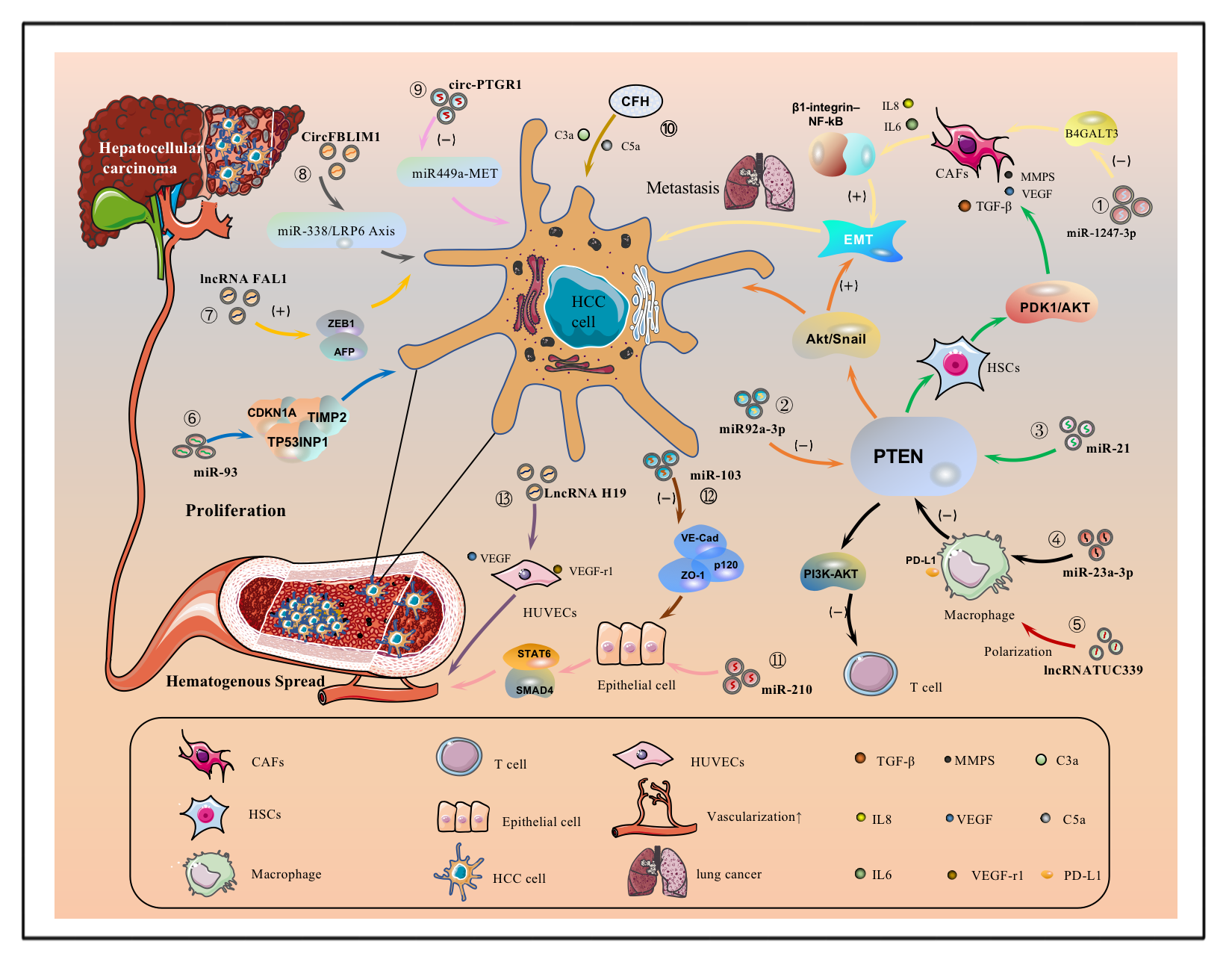
HCC是一种典型的高血管生成肿瘤。HCC细胞来源的EVs,在肿瘤细胞与正常细胞所在的微环境中,建立了互相沟通交流的桥梁,促进HCC增殖、侵袭和远处转移等。肝细胞癌来源的EVs常常会参与自分泌和/或旁分泌细胞通信,从而调节肿瘤的生长。研究表明,肝细胞癌来源的EVs会刺激受体细胞产生促进肝癌细胞迁移和侵袭的物质,如基质金属蛋白酶2(MMP2)和基质金属蛋白酶9(MMP9)。肝细胞癌的发生不仅是因为肝细胞含有足够的基因突变,肝脏微环境中多种相互关联的因素影响着肝癌的进展。 HCC细胞分泌的EVs装载不同的miRNA,LncRNA,circRNA可以激活受体细胞中的信号通路,从而使受体细胞作出应答,影响HCC的迁移和增殖。
图3. HCC细胞衍生的EVs携带货物调控HCC及其他受体细胞
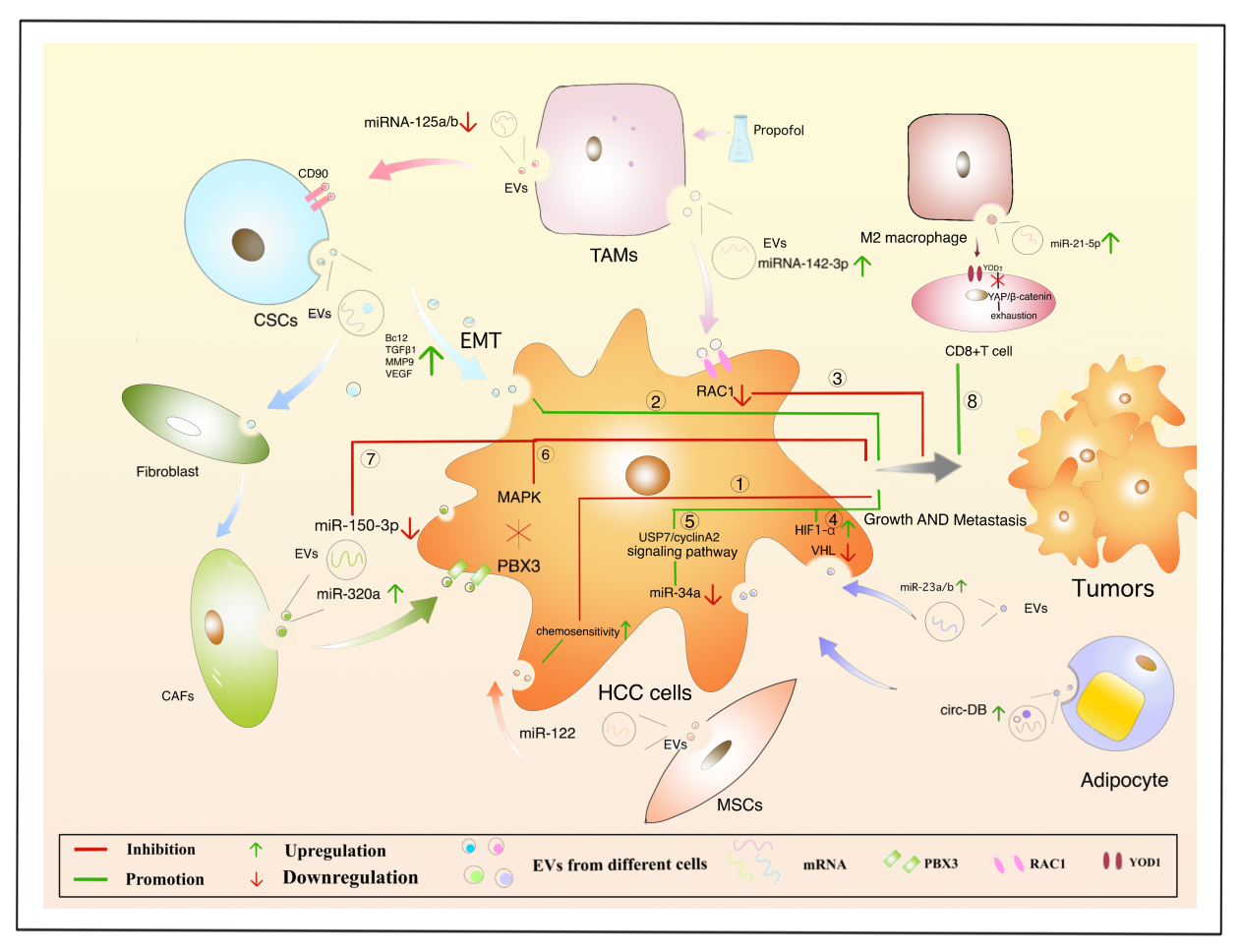
越来越多的证据表明,肝细胞与周围环境组成的动态网络微环境,如癌细胞、细胞因子、细胞外基质和免疫细胞等也是肿瘤进展和转移的关键因素。肝脏中丰富的免疫细胞群是EVs的重要来源。肝脏具有独特的免疫耐受性微环境,这是HCC免疫治疗的巨大挑战。多种免疫抑制细胞亚群和信号通路介导的肿瘤前免疫反应在“肿瘤免疫逃逸”中起着关键作用。作者总结了间充质干细胞、肿瘤干细胞、巨噬细胞、脂肪细胞和成纤维细胞等衍生的EVs对HCC的调控作用。这些研究为肝癌的治疗提供了新的见解和方向,我们需要进行更多的研究以明确具体的生物机制。
图4. 不同细胞衍生的EVs对HCC的调控
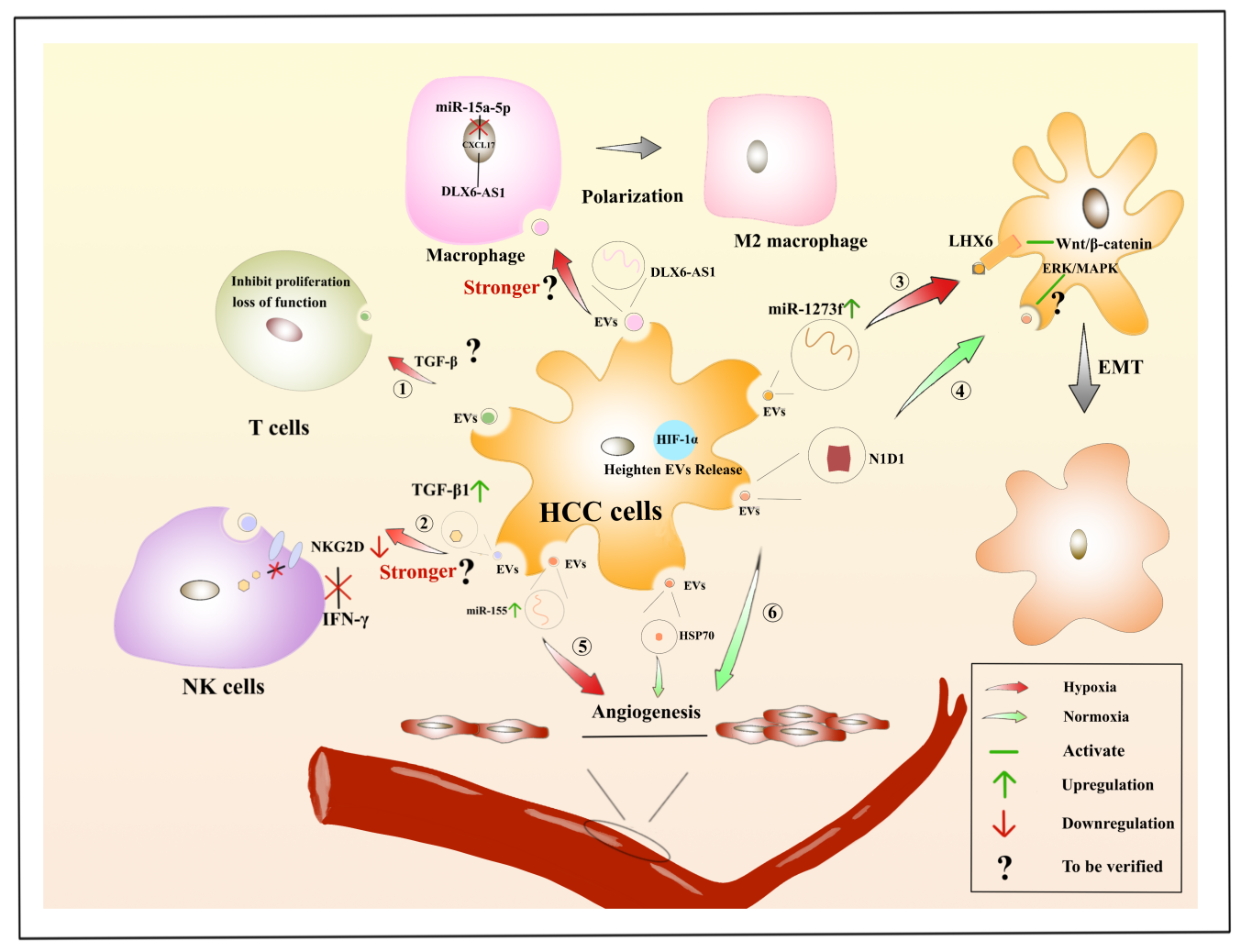
在缺氧环境下,HCC所衍生的EVs可抑制T细胞增殖或使其丧失功能,对于NK细胞的IFN-β生成的抑制作用以及诱导巨噬细胞极化的过程是否加强还有待考证。在缺氧环境下,HCC衍生的EVs中,miR-1273f上调,作用于LHX6激活Wnt/β-catenin以促进EMT,且HCC来源的EVs中miR-155上调,促进血管生成。缺氧诱导癌细胞衍生的外泌体中TGF-β1含量显著增加,并被转移至NK细胞上,降低活化受体NKG2D的表达,抑制NK细胞的细胞毒性以及IFN-γ的产生。肿瘤缺氧微环境与肿瘤的发生发展、治疗和预后密切相关,这已经成为寻找HCC新治疗方法的研究热点。
图5. HCC所衍生的细胞外囊泡在缺氧环境对免疫细胞的作用
总之,EVs是细胞间信息传递的重要纽带,EVs中特定的蛋白和核酸为临床诊断HCC提供了重要的生物标志物。研究者对EVs功能的理解取得一定进展,EVs可以用于肝脏疾病的治疗或肝脏再生,利用EVs将核酸和其他药物运送到肝脏细胞的固有能力,凸显出EVs可能会成为肿瘤诊断和治疗的新靶点,成为未来有效的干预治疗措施,这为肿瘤患者迎来了新的曙光。循环中EVs作为一种新型的信号传导方式,参与了肿瘤的发生发展、转移耐药等多个过程。有关EVs的体内体外实验仍有诸多限制,因此, 迫切需要建立完善的实验模型,进一步探究其性质和作用机制,探索在肿瘤微环境(TME)中利用这种细胞间通信方式进行肿瘤分子诊断和靶向治疗的潜力。
这篇综述的主要内容涵盖以下几点:EVs的种类、生物发生和形态特征;EVs和靶细胞之间摄取和内化的机制;EVs携带蛋白、核酸、线粒体等;EVs的分离、提取和定量方法;HCC细胞 衍生的EVs和HCC的相互作用;微环境中多种细胞衍生的EVs对HCC的调控;缺氧诱导的微环境可影响EVs对HCC的调控;EVs携带的蛋白质和核酸等作为HCC和其他肝病诊断的生物标志物;载药EVs在HCC的应用等。
参考文献:
Extracellular Vesicles and Hepatocellular Carcinoma: Opportunities and Challenges, Front Oncol, 12 (2022) 884369. http://dx.doi.org/10.3389/fonc.2022.884369
外泌体资讯网 Cancer Lett |西北工业大学尹大川团队发现外泌体递送DARS-AS1 siRNA可用于抑制慢性应激诱导的乳腺癌侵袭转移