免疫检查点抑制剂(immune checkpoints inhibitors, ICI)的免疫疗法改变了转移性黑色素瘤(MM)患者的预期寿命。然而,一些患者没有反应,因此,识别和验证对ICI有反应的新型生物标志物至关重要。循环细胞外囊泡(EVs)如PD-L1+ EV介导抗PD1的抗性,但PD1+ EV的作用尚不完全清楚。近日,Molecular Cancer杂志上的一篇文章对黑色素瘤患者循环EV上的PD-1/PD-L1表达进行了评估,发现较高水平的PD-1/PD-L1+ EV与较差的无进展生存期(PFS)和总生存期(OS)显著相关,确定了循环PD1+EV是抗PD1耐药的驱动因素。
在BRAF/MEK靶向治疗和免疫检查点抑制剂(ICI)出现之前,转移性黑色素瘤(MM)的特点是预后不良、总生存期为8-10个月。如今,30%的长期幸存者接受抗PD1单药治疗,50%接受抗CTLA4加抗PD1联合治疗,这象征着免疫治疗改变了MM的预后情况。然而,也出现了许多问题,主要集中在患者对免疫治疗的选择上,因为其中近60%的患者会产生耐药性,还有一些对ICI完全没有反应,原因尚不清楚。迄今为止,患者对免疫治疗的选择是基于PD-L1表达和肿瘤突变负荷的基因组评估。尽管两者都是对ICI反应更好的预测指标,但它们并不完全令人满意,因为这种评估不能有效地捕捉肿瘤的动态空间和时间异质性,另外它们返回的单个突变的抗原价值不明显。理想情况下,血液循环标志物的鉴定可以代表一种有用的策略,以满足实现微创且易于使用的工具的需求,以预测治疗结果和实时监测疾病进展和获得ICI耐药性。在候选预测因子方面,人们越来越关注利用循环细胞外囊泡(EVs)(由正常细胞和癌细胞释放),用于对患者的临床评估。
循环EV是双层脂质膜囊泡,包括凋亡小体、外泌体和微泡,它们携带类似于其亲本来源的丰富分子成分,参与细胞串扰、肿瘤微环境的塑造和免疫逃逸。越来越多的证据表明,循环EV可能会系统性地对抗抗肿瘤免疫,因为检查点配体(例如PD-L1、CTLA4和NKG2D)在其表面表达。由于它们的特性,EV在黑色素瘤中得到了广泛的研究,越来越多的数据表明循环EV是免疫治疗效果的预测生物标志物,因为它们在ICI耐药机制中发挥作用(https://www.exosomemed.com/4924.html)。因此,作者此前的研究发现从黑色素瘤、CD8+ T细胞和树突状细胞释放的循环uPAR+(尿激酶型纤溶酶原激活物受体)EV的显著增加与随后接受nivolumab或pembrolizumab治疗的MM患者队列的无反应相关,进一步支持基于EV的生物标志物是预测对ICI的先天抗性的有力工具。
最近,研究证明患者对ICI治疗的结果与可溶性循环PD1水平之间存在负相关,但循环PD1的重要性仍未完全了解。由于有证据表明EV是循环PD1的主要来源,作者试图在同一组MM患者中了解PD1是否在循环EV的膜上表达,以及假定的患者血浆中的PD1+ EV系统性增加可能导致与抗PD1无反应相关。此外,作者对循环EV上的PD-L1表达进行了评估,以深入了解PD1/PDL-1免疫检查点轴的EV表达对预测ICI反应的影响。为了评估PD1+EV和PDL-1+EV的预测潜力,研究将患者血浆中此类EV的百分比与其ICI治疗的结果相关联。
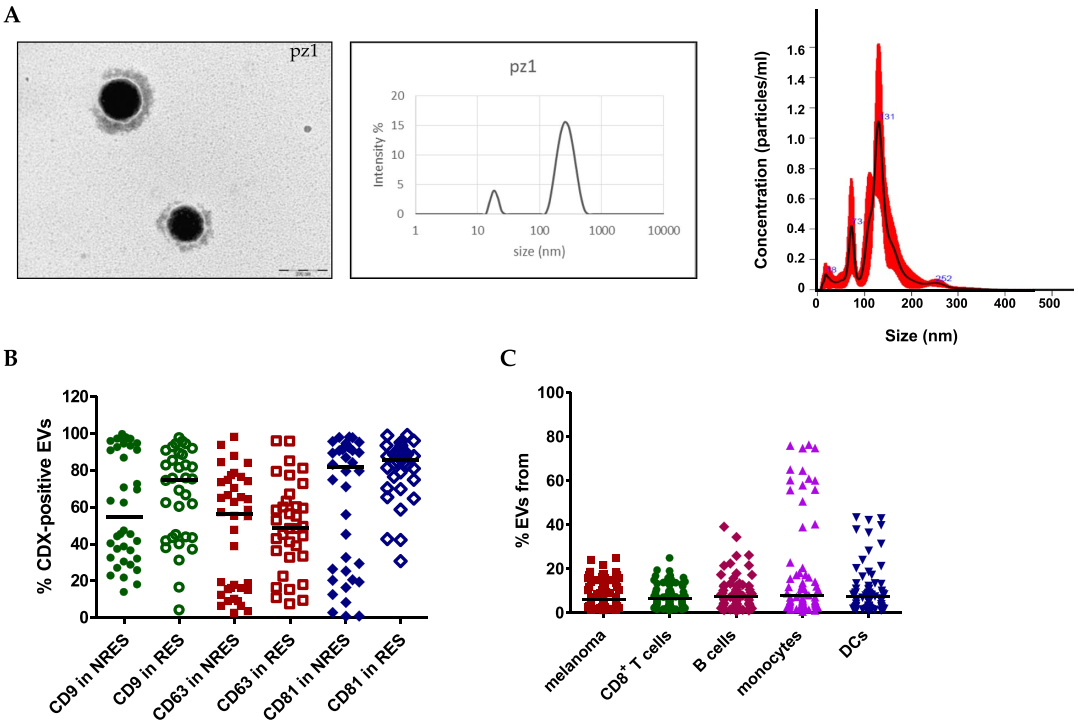
循环EVs的表征
然而,鉴于作者之前的研究表明,不是循环EV的负担,而是对EV群体的细胞来源进行解析,这允许区分ICI的响应者和非响应者,通过考虑百分比来执行相关性多变量分析中从肿瘤和非肿瘤细胞(免疫细胞)释放的PD1+EV和PDL-1+EV。为了评估PD1+EV是否可能导致对抗PD1无反应,进行了体外实验以评估它们是否参与治疗性单克隆抗体nivolumab的治疗抗性,以及循环EV是否影响免疫细胞介导的黑色素瘤杀伤,以证明它们介导了治疗失败。最后,在最近参加研究的9名反应者和13名无反应者的验证队列中验证了多变量分析中确定的独立因素作为反应的生物标志物。
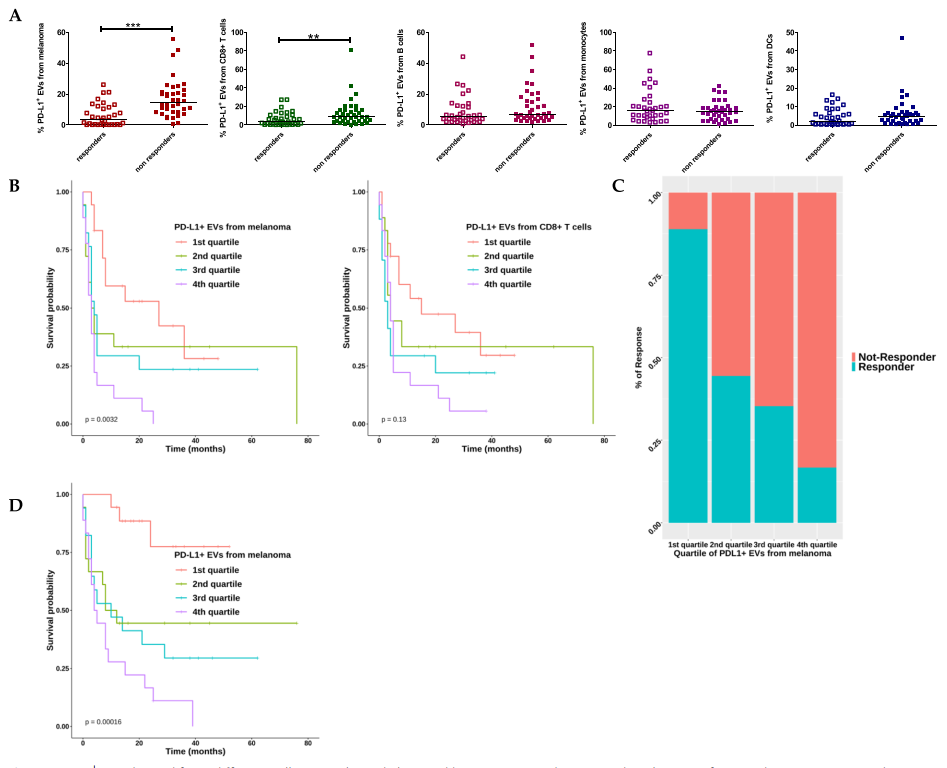
PD-L1+EVs与治疗反应、PFS、OS的相关性评估
该研究从71名转移性黑色素瘤患者观察性队列的血浆中分离出循环EV,并将PD-L1+EV和PD1+EV的数量与对ICI的反应相关联。分析是根据来自肿瘤和免疫细胞的EV的来源进行的。随后,分析了22名MM患者的验证队列中的数据,以评估已确定的基于EV的生物标志物的可靠性。此外,评估了PD1+EV参与nivolumab的治疗抗性和免疫细胞介导的黑色素瘤球体杀伤的抑制。
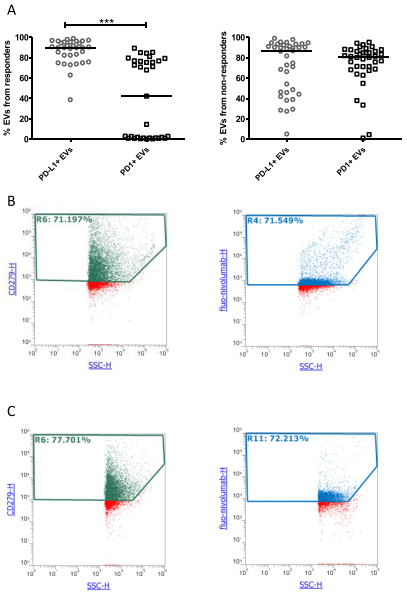
PD1+ EVs结合nivolumab
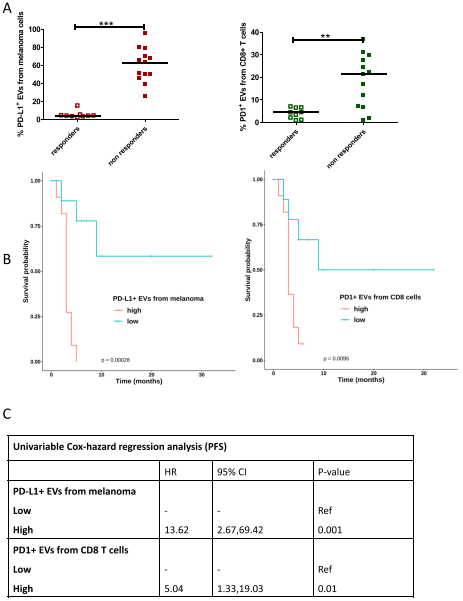
研究发现,从黑色素瘤和CD8+T细胞释放的PD-L1+EV的水平以及无论细胞来源的PD1+EV的水平在无应答者中较高。Kaplan-Meier曲线表明,较高水平的PD1+EV与较差的无进展生存期(PFS)和总生存期(OS)显著相关。仅当从黑色素瘤和T细胞释放时,PD-L1+EV才发现显著相关性。多变量分析表明,来自T细胞和B细胞的高水平PD1+EV和来自黑色素瘤细胞的高水平PD-L1+EV是反应的独立生物标志物。通过单变量Cox回归分析,验证队列中证实了来自黑色素瘤的PD-L1+EV和来自T细胞的PD1+EV在预测PFS方面的可靠性。此外,研究发现循环中的EV捕获了nivolumab并减少了T细胞的运输和肿瘤球体的杀伤。
该研究确定循环PD1+EV是抗PD1耐药的驱动因素,并强调通过液体活检分析单个EV群体是对MM患者进行免疫治疗分层的有前景的工具。
验证队列中应答者和无应答者黑色素瘤和T细胞的PD-L1+EV和PD1+EV
参考文献:
SerratìS, Guida M, Di Fonte R, De Summa S, Strippoli S, Iacobazzi RM, Quarta A, DeRisi I, Guida G, Paradiso A, Porcelli L, Azzariti A. Circulatingextracellular vesicles expressing PD1 and PD-L1 predict response and mediateresistance to checkpoint inhibitors immunotherapy in metastatic melanoma. MolCancer. 2022 Jan 18;21(1):20. doi: 10.1186/s12943-021-01490-9.PMID: 35042524.
外泌体资讯网 Mol Cancer:表达PD1和PD-L1的循环细胞外囊泡可预测转移性黑色素瘤对检查点抑制剂免疫治疗的反应并介导耐药性