CD8+T细胞缺乏肿瘤浸润与患者对抗PD-1治疗反应不佳有关。了解如何调节肿瘤浸润是提高治疗效果的关键。近日,宾夕法尼亚大学医学院的郭巍教授在Nature Communications杂志上发表文章,报道发现HRS(参与外泌体生物发生的ESCRT复合物的关键成分)的磷酸化限制了溶细胞性CD8+T细胞的肿瘤浸润。

使用抗程序性死亡蛋白1(PD-1)抗体的免疫检查点阻断(ICB)已证明可有效治疗多种类型的癌症。尽管取得了显著进展,但大多数患者对ICB疗法没有反应。最近的研究表明,具有高肿瘤内而非肿瘤周围CD8+T细胞的患者对ICB有更好的反应。为了提高免疫治疗的疗效,必须促进溶细胞性CD8+T细胞的肿瘤内迁移。然而,调节CD8+T细胞浸润肿瘤的分子机制仍不清楚。外泌体是细胞分泌的小细胞外囊泡(sEV),可有效影响细胞间的通讯。外泌体中货物表达的异质性是外泌体多样化功能的基础。阐明外泌体的货物分选机制是理解外泌体异质性及其功能的关键。运输所需的内体分选复合物(ESCRT)在外泌体生物发生中起着重要作用。HRS(也称为HGS,肝细胞生长因子调节的酪氨酸激酶底物)是ESCRT的关键组成部分,因为它介导最初的货物识别和分选进多泡内体(MVE),然后将其输送到质膜进行外泌体分泌。肿瘤细胞分泌携带PD-L1的外泌体,PD-L1是一种关键的免疫检查点蛋白。肿瘤细胞中如何调节外泌体的PD-L1负载是未知的。
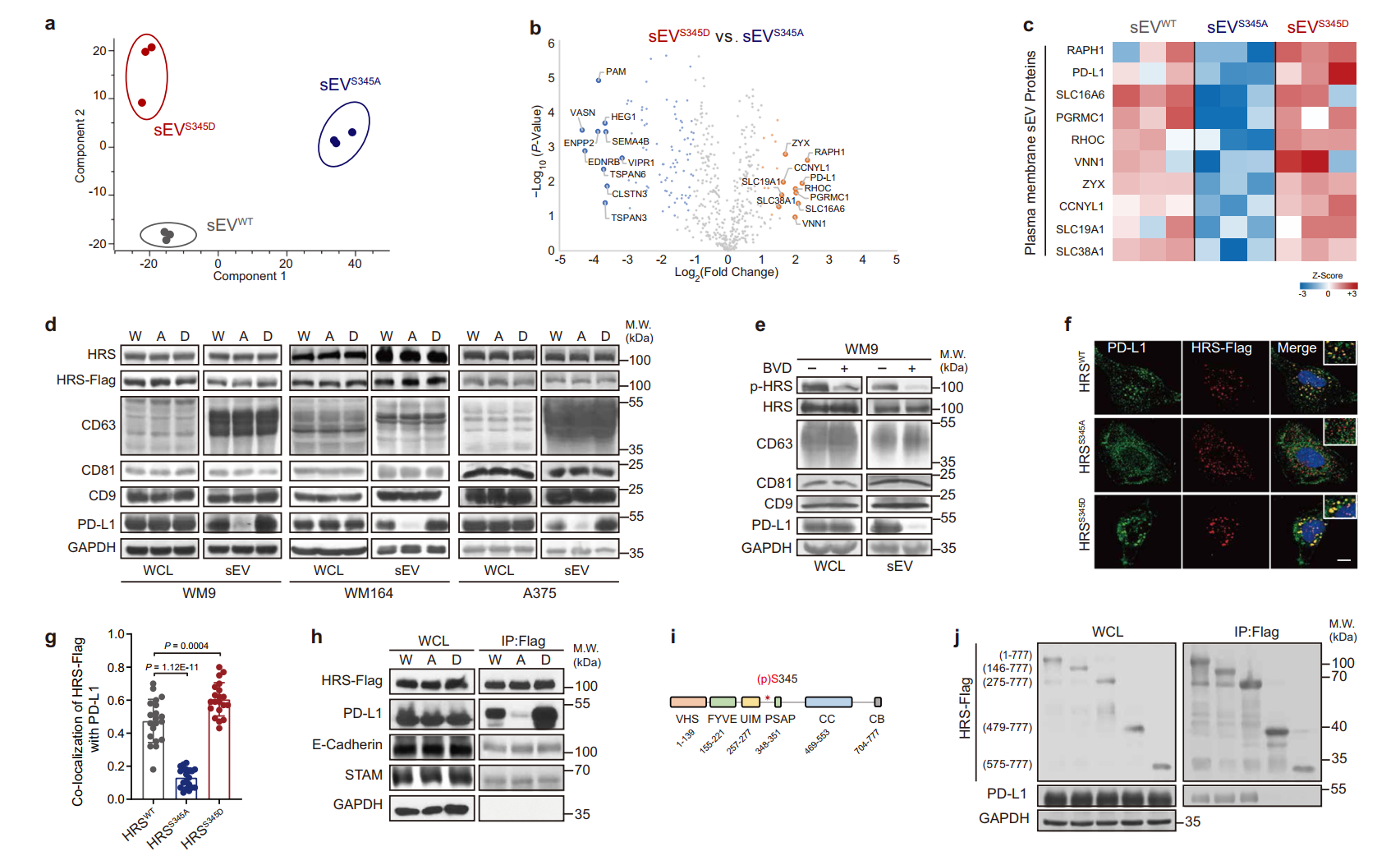
HRS的S345磷酸化选择性富集PD-L1到sEV 中该研究发现,在细胞外信号调节激酶(ERK)磷酸化后,HRS在空间上排除了CD8+T细胞浸润到黑色素瘤肿瘤组织中。从机制上讲,磷酸化HRS与PD-L1强烈相互作用,并选择性地促进PD-L1加载到外泌体,从而阻断CD8+T细胞浸润。在各种小鼠模型中,组成型磷酸化HRS的表达导致抗PD-1治疗的抗性,而HRS磷酸化的抑制增强了PD-1阻断的治疗效果。研究揭示了致癌信号通过PD-L1加载到外泌体来调节抗肿瘤免疫的机制,并建议抑制HRS磷酸化作为增强ICB治疗的潜在策略。
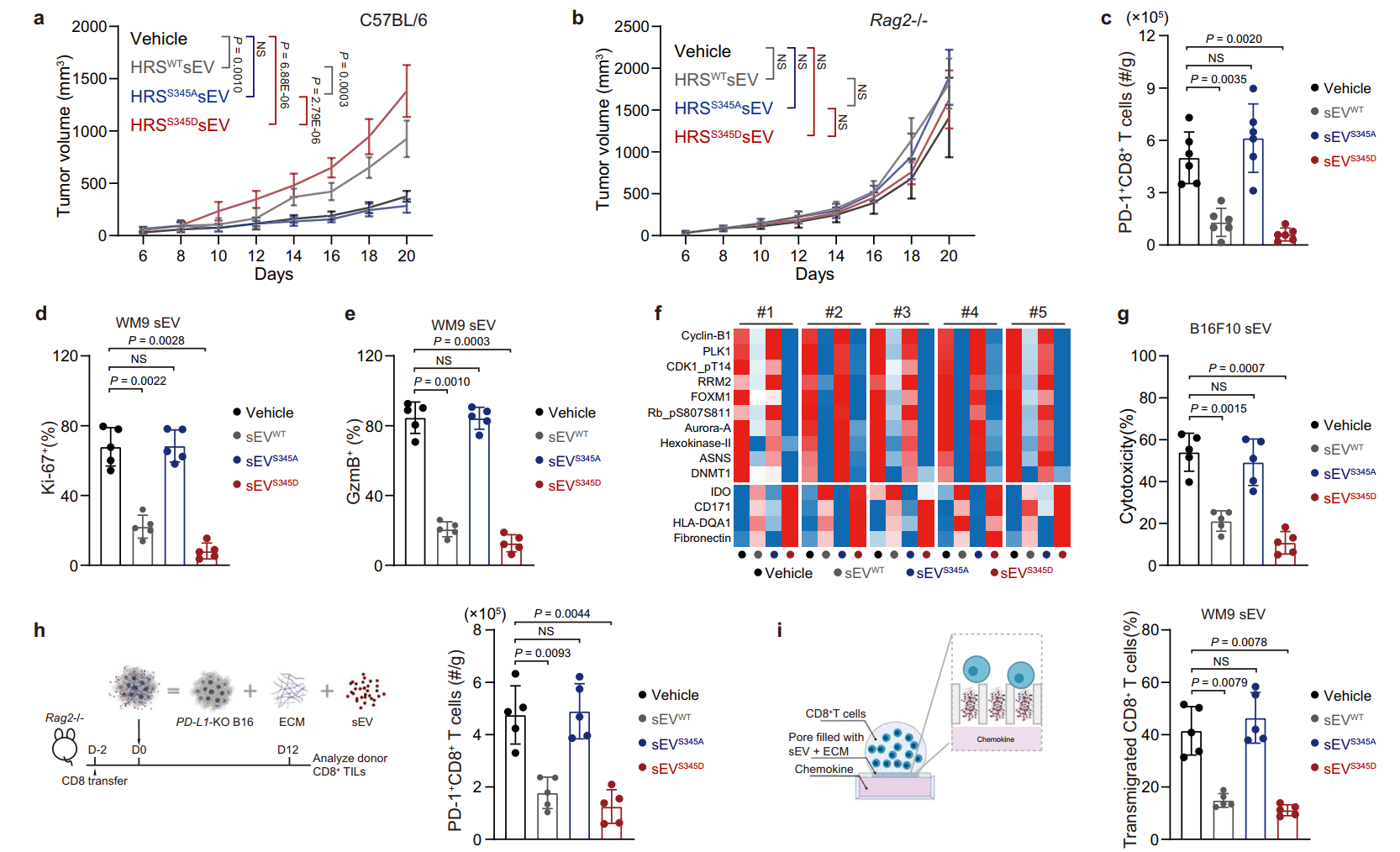
HRS磷酸化增强sEV对CD8+T细胞的抑制作用
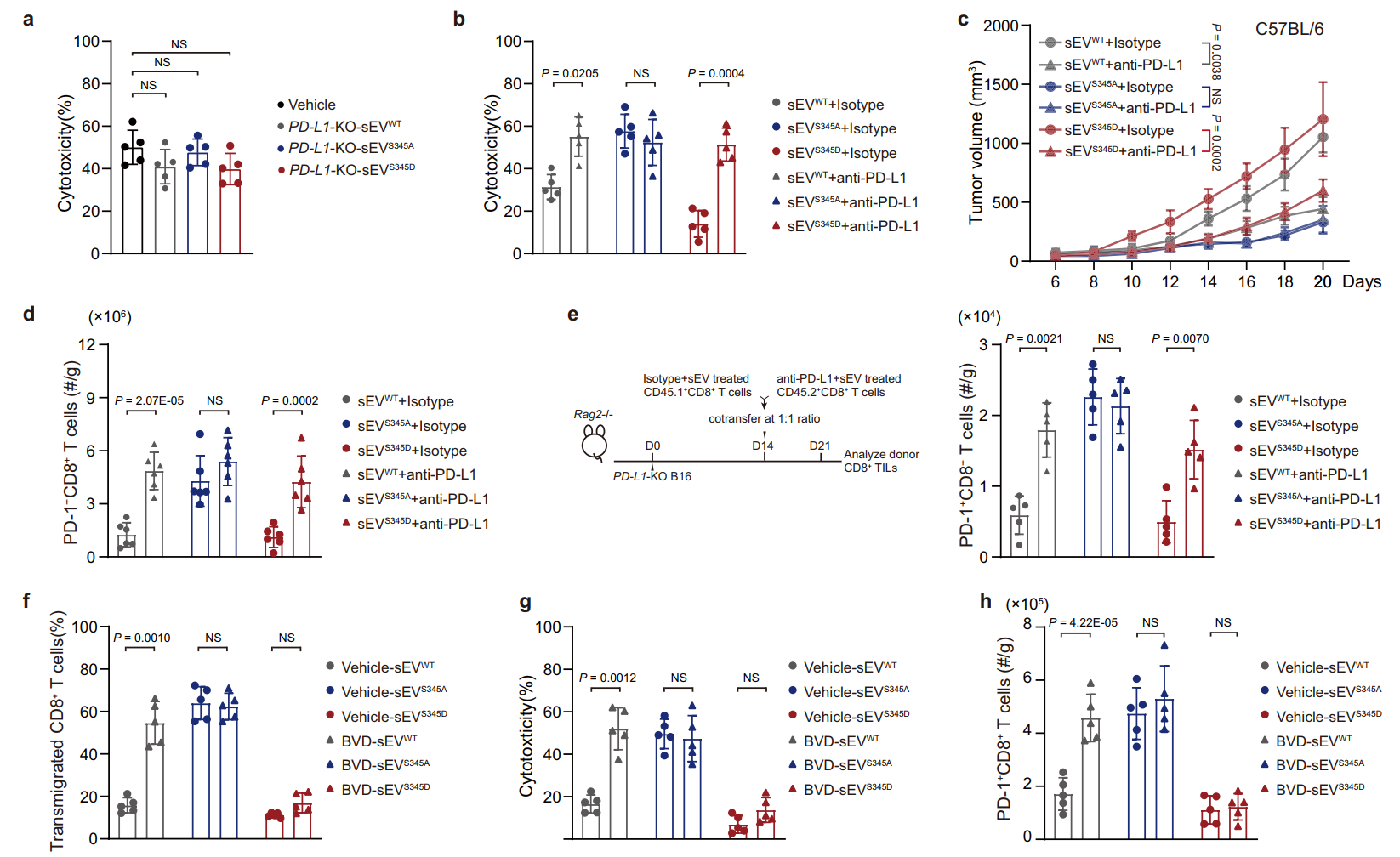
富含PD-L1的外泌体通过HRS磷酸化诱导CD8+T细胞抑制
在ERK介导的磷酸化后,HRS与外泌体相互作用并介导PD-L1的选择性负载,从而抑制CD8+T细胞迁移到肿瘤中。在黑色素瘤患者的组织样本中,CD8+T细胞被排除在肿瘤细胞含有高水平磷酸化HRS的区域之外。在小鼠肿瘤模型中,磷酸化HRS的过表达增加了对抗PD-1治疗的抗性,而HRS磷酸化的抑制增强了治疗效果。研究揭示了肿瘤细胞中HRS磷酸化通过诱导PD-L1+免疫抑制外泌体调节抗肿瘤免疫的机制,并表明HRS磷酸化阻断是提高癌症免疫治疗疗效的潜在策略。郭巍教授曾于2018年在Nature杂志发表文章报道癌细胞释放PD-L1外泌体如“无人机”远程对抗免疫系统(相关报道:Nature重磅!癌细胞释放PD-L1外泌体如“无人机”远程对抗免疫系统)参考文献:Guan L, Wu B, Li T, Beer LA, Sharma G, Li M, Lee CN, Liu S, Yang C, Huang L, Frederick DT, Boland GM, Shao G, Svitkina TM, Cai KQ, Chen F, Dong MQ, Mills GB, Schuchter LM, Karakousis GC, Mitchell TC, Flaherty KT, Speicher DW, Chen YH, Herlyn M, Amaravadi RK, Xu X, Guo W. HRS phosphorylation drives immunosuppressive exosome secretion and restricts CD8+ T-cell infiltration into tumors. Nat Commun. 2022 Jul 14;13(1):4078. doi: 10.1038/s41467-022-31713-6. PMID: 35835783.