STING(干扰素基因的刺激物)激动剂的效果不佳归因于多种因素,主要是细胞内递送效率低下,许多肿瘤中STING的表达低/缺失,以及肿瘤控制和进展之间的复杂平衡。近日,来自北卡罗来纳大学教堂山分校的Rihe Liu与Jenny P-Y Ting团队合作在Nature Nanotechnology杂志上发表文章,报告了一种基于聚合物结构的通用STING模拟物(uniSTING)。UniSTING在一系列的小鼠和人类细胞类型中激活STING信号,独立于内源性STING的表达,并选择性地刺激肿瘤控制IRF3/IFN-I途径,而不是肿瘤进展NF-κB途径。从uniSTING处理的肿瘤细胞释放的细胞外囊泡,通过内含的miRNAs进一步刺激树突状细胞。
哺乳动物的环磷酸鸟苷酸合酶(cGAS)与DNA结合后,会生成2′3′-cGAMP,它与内质网(ER)膜上的适配蛋白STING(干扰素基因刺激物)的同源二聚体结合,形成多聚STING结构,这对激活下游信号通路至关重要。激活的STING引发主要涉及干扰素(IFN)调控因子3(IRF3)和核因子(NF-κB)的转录级联反应,从而上调I型IFNs、促炎细胞因子和趋化因子的转录。最近的研究已经证明,STING激活和随后的IFN-I分泌在抗癌免疫中起着关键作用。正在进行的几项临床试验正在研究基于环二核苷酸(CDN)的STING激动剂的治疗潜力。然而,这些化合物的稳定性差和剂量依赖性毒性使得它们的临床应用面临困难。最近,报道了具有改善的抗肿瘤效果和扩大适应症的口服非核苷STING激动剂。尽管它们具有治疗潜力,但所有基于CDN和非核苷的STING激动剂在肿瘤也表达STING时才最为理想。已有几项研究表明,由于STING或其上游调控因子cGAS的表观遗传沉默或错义突变,肿瘤细胞中的STING信号通路被抑制。尽管最近报道了STING的一些始终活跃的突变,如V155M,但其有效性和安全性尚未在临床试验中进行研究。此外,cGAS/STING激活的下游NF-κB/ IL6/STAT3轴促进癌细胞的进展,反映了STING激活的多效应。因此,迫切需要开发新的STING刺激剂,这些刺激剂可以诱导STING介导的免疫反应,而不考虑是否存在内源性STING。该研究在广泛的癌症类型中使用了一种通用的STING激活策略,但不促进癌症的生长。STING的聚合和转运对其下游免疫反应至关重要。当STING与cGAMP结合时,其跨膜域会发生构象变化,形成一个并排的四聚体,这个四聚体可能会进一步生长成更大的寡聚体。通过将多个TANK结合激酶1 (TBK1)二聚体聚集在一起进行激活环的跨自磷酸化,这种基于四聚体的STING的高级结构为STING的C端尾部的磷酸化提供了一个有效的支架,这反过来又招募并激活IRF3,以增加IFN-I的上调。尽管STING的跨膜域在其激活中的作用仍然不明确,但有强有力的证据表明,基于四聚体的STING的高级结构在启动下游信号反应中起着核心作用。更重要的是,STING的转运可能会塑造下游的转录级联。当STING退出内质网时,会发生NF-κB信号级联,而IRF3的激活需要STING存在于晚期内质网。为了解决某些肿瘤中功能性STING信号的缺乏,该研究报告了一种有效的通用STING模拟物(uniSTING),通过将高度稳定的四聚体化模式与STING的非膜结合域进行遗传融合来设计。UniSTING可以自组装成四聚体STING,并进一步核化成独立于内质膜系统的聚合STING,具有更高阶的结构。UniSTING模仿cGAMP诱导的内源性STING的寡聚化,导致STING下游途径的持续激活,这有利于IRF3/IFN-I级联反应超过促炎NF-κB信号。利用脂质纳米颗粒(LNP)-mRNA,它允许有效的细胞内递送和显著增强先天反应,将编码鼠源uniSTING融合蛋白的mRNA封装到LNPs中,用于递送到肿瘤微环境(TME)。UniSTING诱导了鼠类树突状细胞(DCs)和肿瘤细胞中TBK1和IRF3的磷酸化以及随后的IFN-β和ISG的大量产生,而NF-κB途径的激活很少。这激活了成熟的DCs以引发增强的T细胞反应。重要的是,uniSTING的人类版本(huSTING)在激活STING途径方面也显示出与STING缺失的人类卵巢癌细胞或单核细胞相当的效果。在STING缺失的骨髓来源的DCs(BMDCs)中也观察到STING信号的强烈激活,表明uniSTING独立于内源性STING表达工作。因此,LNP-uniSTING-mRNA治疗抑制了肿瘤生长,并改善了野生型(WT)和STING−/−小鼠的存活。从机制上讲,细胞外囊泡(EVs)在uniSTING治疗后促进了肿瘤细胞-DC交互。对microRNA(miRNA)谱的无偏评估揭示,从uniSTING处理的肿瘤细胞释放的EVs含有显著增加的miRNAs,包括miR-130-3p,miR-15b-5p和miR-16-3p。这些miRNAs降低了DCs中免疫抑制蛋白Wnt2b的表达,进一步改善了DC功能。与这些发现一致,LNP-uniSTING-mRNA与抗-Wnt2b抗体的组合在抑制肿瘤生长和延长生存方面优于任何一种单独使用。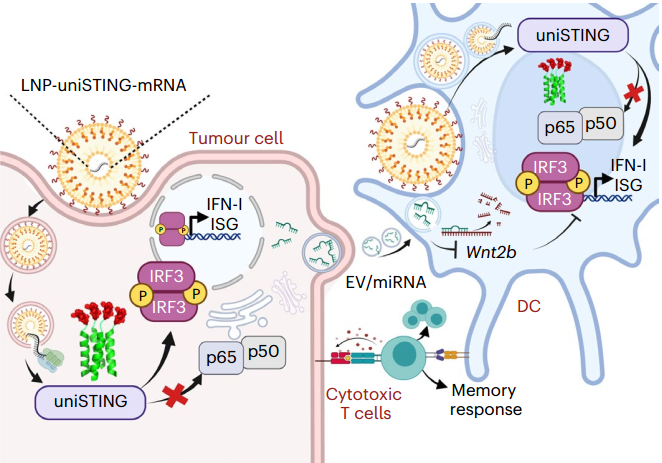 图、LNP-uniSTING-mRNA诱导了STING的持续激活和肿瘤细胞与DC细胞之间的EV介导的交叉通讯。LNP-uniSTING-mRNA治疗导致肿瘤细胞和DC细胞中表达出一种通用的STING模拟物,这种模拟物自组装成四聚体亚基,然后形成更高级别的STING结构,以实现IRF3的有效下游磷酸化和随后的I型干扰素和ISG细胞因子的释放。uniSTING处理的肿瘤细胞释放的EV进一步通过分泌miRNA(包括miR-130-3p、miR-15b-5p和miR-16-3p)来增强DC在肿瘤微环境(TME)中的功能,这些miRNA针对Wnt2b并减少了免疫抑制信号分子。通过脂质纳米颗粒(LNPs)进行肿瘤内或全身注射的uniSTING-mRNA,可以在包括三阴性乳腺癌、肺癌、黑色素瘤和原位/转移性肝恶性肿瘤等肿瘤模型中,产生强大的抗肿瘤效果。此外,uniSTING显示出优于2’3’-cGAMP和ADU-S100的有效抗肿瘤反应。通过优先选择IRF3/IFN-I活性而不是促炎NF-κB信号通路,uniSTING促进树突状细胞的成熟和抗原特异性CD8+T细胞的反应。从uniSTING处理的肿瘤细胞释放的细胞外囊泡,通过内含的miRNAs进一步使树突状细胞敏感,这些miRNAs减少了免疫抑制的Wnt2b,而LNP-uniSTING-mRNA与α-Wnt2b抗体的组合协同抑制肿瘤生长并延长动物的生存。总的来说,这些结果证明了LNP介导的uniSTING-mRNA的递送作为一种策略,可以克服当前STING治疗的障碍,特别是对于STING下调或缺失的多种癌症类型的治疗。Wang Y, Li S, Hu M, Yang Y, McCabe E, Zhang L, Withrow AM, Ting JP, Liu R. Universal STING mimic boosts antitumour immunity via preferential activation of tumour control signalling pathways. Nat Nanotechnol. 2024 Mar 13. doi: 10.1038/s41565-024-01624-2. PMID: 38480836.
图、LNP-uniSTING-mRNA诱导了STING的持续激活和肿瘤细胞与DC细胞之间的EV介导的交叉通讯。LNP-uniSTING-mRNA治疗导致肿瘤细胞和DC细胞中表达出一种通用的STING模拟物,这种模拟物自组装成四聚体亚基,然后形成更高级别的STING结构,以实现IRF3的有效下游磷酸化和随后的I型干扰素和ISG细胞因子的释放。uniSTING处理的肿瘤细胞释放的EV进一步通过分泌miRNA(包括miR-130-3p、miR-15b-5p和miR-16-3p)来增强DC在肿瘤微环境(TME)中的功能,这些miRNA针对Wnt2b并减少了免疫抑制信号分子。通过脂质纳米颗粒(LNPs)进行肿瘤内或全身注射的uniSTING-mRNA,可以在包括三阴性乳腺癌、肺癌、黑色素瘤和原位/转移性肝恶性肿瘤等肿瘤模型中,产生强大的抗肿瘤效果。此外,uniSTING显示出优于2’3’-cGAMP和ADU-S100的有效抗肿瘤反应。通过优先选择IRF3/IFN-I活性而不是促炎NF-κB信号通路,uniSTING促进树突状细胞的成熟和抗原特异性CD8+T细胞的反应。从uniSTING处理的肿瘤细胞释放的细胞外囊泡,通过内含的miRNAs进一步使树突状细胞敏感,这些miRNAs减少了免疫抑制的Wnt2b,而LNP-uniSTING-mRNA与α-Wnt2b抗体的组合协同抑制肿瘤生长并延长动物的生存。总的来说,这些结果证明了LNP介导的uniSTING-mRNA的递送作为一种策略,可以克服当前STING治疗的障碍,特别是对于STING下调或缺失的多种癌症类型的治疗。Wang Y, Li S, Hu M, Yang Y, McCabe E, Zhang L, Withrow AM, Ting JP, Liu R. Universal STING mimic boosts antitumour immunity via preferential activation of tumour control signalling pathways. Nat Nanotechnol. 2024 Mar 13. doi: 10.1038/s41565-024-01624-2. PMID: 38480836.外泌体资讯网 【Nat Nanotechnol】通用STING模拟物优先激活肿瘤控制信号通路增强抗肿瘤免疫力


