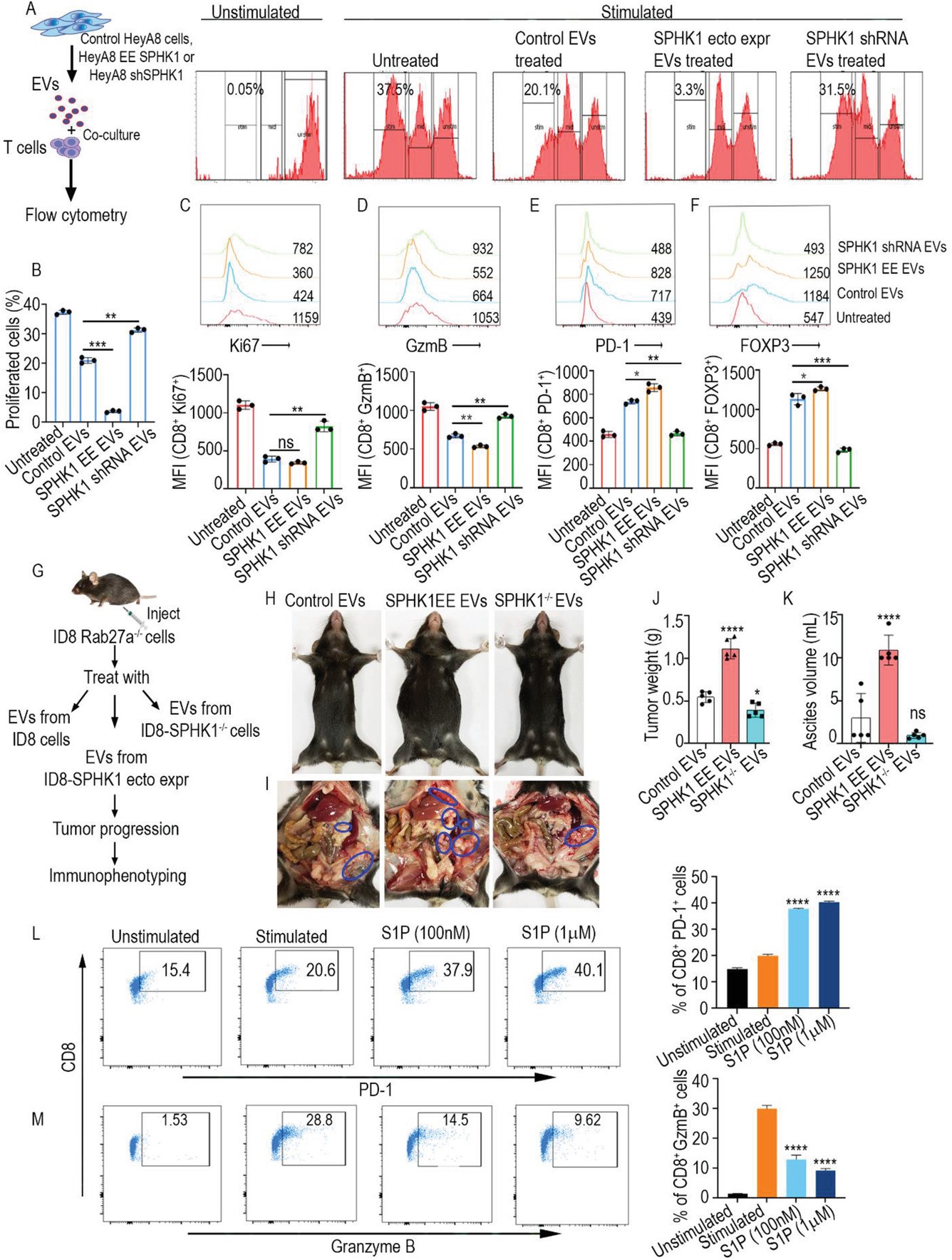
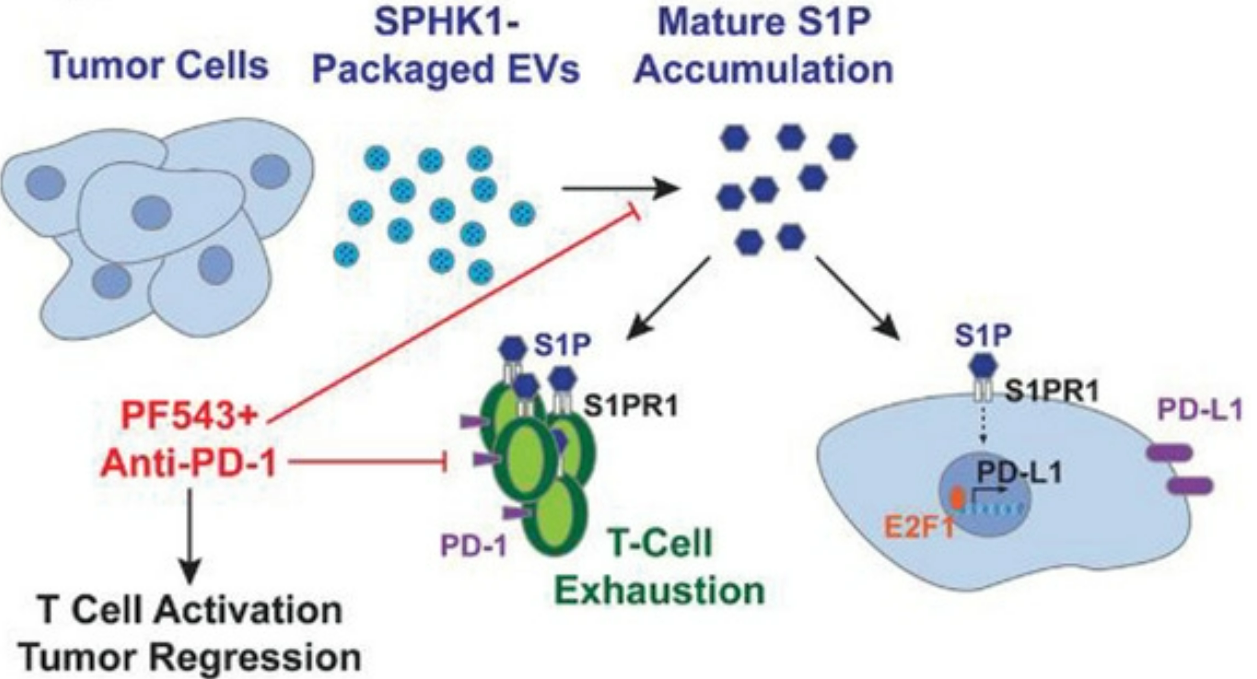
SPHK1(鞘氨醇激酶-1)催化鞘氨醇(sphingosine)磷酸化为1-磷酸鞘氨醇(S1P),被发现在实体瘤中高表达。近日,Advanced Science杂志上发表一篇文章,报道发现细胞外囊泡(EV)是SPHK1存在于肿瘤微环境的关键转运蛋白。因此,包装SPHK1的EV提高了肿瘤微环境中的S1P水平,其中S1P表现为免疫抑制性。然而,S1P如何介导其在癌症中的免疫抑制作用的确切机制尚不清楚。研究表明S1P可以诱导T细胞衰竭。S1P还可以通过E2F1介导的转录上调程序性死亡配体1(PDL-1)的表达。值得注意的是,SPHK1抑制剂PF543提高了T细胞介导的细胞毒性。此外,在体内将PF543与抗PD-1抗体组合比单独使用PF543更有效地减少肿瘤负荷和转移。这些数据证明了一种以前未被认识的机制,即包装SPHK1的EV如何促进卵巢癌的进展,因此提出了抑制SPHK1/S1P信号传导以改善卵巢癌免疫检查点阻断(抗PD-1抗体)治疗的潜在临床应用。检查点免疫疗法试验,例如程序性细胞死亡蛋白-1/程序性死亡配体-1(PD-1/PD-L1)抑制剂疗法,在卵巢癌患者的治疗初期似乎很有希望。然而,广泛的研究表明反应率相当低:<5%,无论使用哪种药物靶向PD-1/PD-L1。最近,发现靶向免疫代谢作为增强抗PD-1治疗的潜在机制对黑色素瘤有效。一种治疗黑色素瘤的机制是免疫代谢物1-磷酸鞘氨醇(S1P)。S1P在鞘氨醇激酶1(SPHK1)磷酸化鞘氨醇时合成。SPHK1/S1P信号传导与癌症进展和转移有关,因为它调节许多关键的致癌事件,例如增殖、迁移、侵袭、粘附、血管生成和细胞凋亡。与这些观察结果一致,作者发现高级别浆液性卵巢癌患者血浆中S1P水平升高,组织样本中SPHK1酶高表达。此外,还已知S1P信号传导可控制免疫细胞运输。最近,研究发现S1P可以调节影响肿瘤微环境(TME)中T细胞代谢适应性的上游信号传导。靶向S1P信号以双重方式改善肿瘤控制:通过抑制肿瘤生长和增加T细胞的抗肿瘤活性。虽然众所周知SPHK1在细胞内磷酸化鞘氨醇以形成S1P,但作者最近发现卵巢癌细胞释放携带SPHK1的细胞外囊泡(EV)进入TME,从而使S1P在癌细胞外产生。已知EV通过促进转移、免疫调节、血管生成和组织再生来影响肿瘤进展。然而,含有SPHK1以及因此S1P升高的EV如何调节肿瘤微环境尚不清楚。此外,缺乏关于S1P影响免疫细胞对癌细胞反应性的数据。在评估肿瘤微环境中调节S1P水平的机制时,作者发现S1P上调肿瘤细胞中PD-L1的表达,激活耗尽细胞毒性T细胞活性的T细胞死亡机制。这些发现使作者在卵巢癌的同基因模型中将PF543(一种SPHK1抑制剂)与抗PD-1疗法相结合。研究发现肿瘤负荷显著降低,并提高了体内存活率。使用体内和体外方法,研究证明了i) EVs-SPHK1(SPHK1包装的EVs)诱导卵巢癌的免疫抑制和 ii) 用特异性抑制剂PF543靶向SPHK1,并结合抗PD-1治疗增强卵巢癌患者的免疫激活,从而提高生存率。GuptaP, Kadamberi IP, Mittal S, Tsaih SW, George J, Kumar S, Vijayan DK, GeethadeviA, Parashar D, Topchyan P, McAlarnen L, Volkman BF, Cui W, Zhang KYJ, Di VizioD, Chaluvally-Raghavan P, Pradeep S. Tumor Derived Extracellular VesiclesDrive T Cell Exhaustion in Tumor Microenvironment through Sphingosine MediatedSignaling and Impacting Immunotherapy Outcomes in Ovarian Cancer. AdvSci (Weinh). 2022 Mar 15:e2104452. doi: 10.1002/advs.202104452.PMID: 35289120.外泌体资讯网 Adv Sci:肿瘤EVs通过鞘氨醇激酶驱动肿瘤微环境中的T细胞耗竭