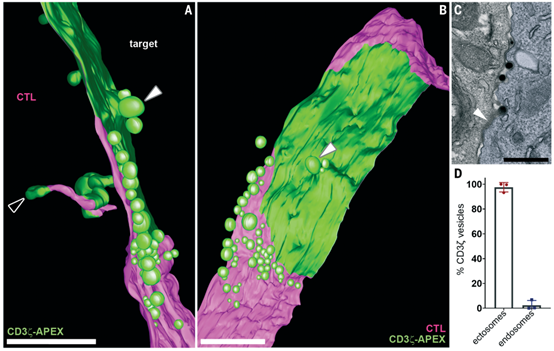
细胞毒性T淋巴细胞(CTLs)通过T细胞受体(TCR)识别并杀死病毒感染和癌细胞。CTLs如何终止信号传导并分离以允许连续杀伤一直是个谜。近日,Science杂志主刊发表文章,报道了激活的TCR被脱落到富含DAG的细胞外囊泡ectosomes(胞外体)中。ectosomes被靶细胞直接内吞,从而终止TCR信号传导并同时使CTL与靶细胞分离,以允许连续杀伤。因此,外泌作用使TCR信号传导自我限制。
在细胞毒性T淋巴细胞(CTLs)的免疫应答和癌症免疫治疗中,连续杀伤多个靶细胞的能力是其有效性的重要因素。这种连续杀伤需要从识别到与每个靶细胞分离的精心控制的过渡。TCR-CD3复合物由TCRs(a和b)和一组CD3链(g、d、e和z)组成,后者是信号传导所必需的。TCR与靶细胞上的肽-主要组织相容性复合物I(pMHCI)结合会通过淋巴细胞特异性蛋白酪氨酸激酶(Lck)和Zeta链相关蛋白激酶70(Zap70)迅速磷酸化TCR复合物,从而启动下游信号传导。TCR激活可以通过内吞作用下调表面TCR表达,使用人工免疫突触在脂质双层上进行的研究还表明,TCRs可以通过外泌体(exosomes)和ectosomes脱落。什么决定了TCR下调的路线尚不清楚。
使用电子显微镜断层扫描技术,该研究在CTL和靶细胞之间形成的免疫突触上生成了>1毫米深度的三维视图。结合>800张透射电子显微镜(TEM)图像和>8000张免疫荧光图像,研究了免疫突触内TCR的命运。研究发现,激活的TCR不是通过内吞作用而是通过富含DAG的细胞外囊泡ectosomes从免疫突触中脱落。在ectosomes从CTLs中分裂出来时,它们会形成一个细胞分离区域,这使得CTLs可以在TCR信号停止后与其靶细胞分离。随着信号强度的增加,膜泡外分泌(ectocytosis)作用和CTL分离都增加了。
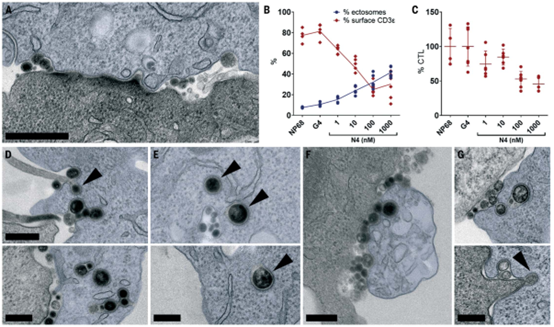 胞外体通过网格蛋白介导的内吞作用内化到靶细胞中
胞外体通过网格蛋白介导的内吞作用内化到靶细胞中
该研究为TCR激活后下调的现象提供了见解。虽然TCR内吞作用和随后的降解一直被认为是TCR下调的关键机制,但该研究表明,在免疫突触中,激活的TCR通过外泌作用优先脱落到富含DAG的ectosomes中。有两条证据支持该研究的结论,即激活的TCR内吞作用在突触上被抑制。首先,结构研究表明,适配器蛋白-2(AP2)需要膜中的PIP2来招募衬里和启动内吞作用。因此,在TCR激活后,当PIP2在免疫突触上耗尽时,AP2将无法启动内吞作用。其次,已经表明,当酪氨酸磷酸化时,AP2无法结合YXXF内吞作用基序(其中Y是酪氨酸,X是任何氨基酸,F是任何笨重的疏水性氨基酸)。因为20个功能性YXXF内吞作用基序嵌入在免疫受体酪氨酸基激活基序(ITAMs)中,在这些序列中,酪氨酸残基在TCR激活期间被磷酸化,激活的TCR将不会被AP2识别。因此,在激活后,内吞作用将被抑制,外泌作用将在免疫突触中得到优先。
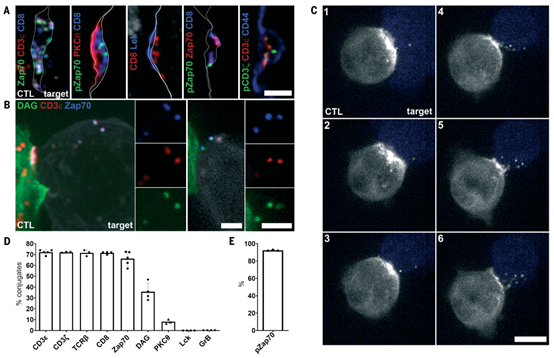 激活的TCR和Zap70脱落到胞外体中
激活的TCR和Zap70脱落到胞外体中
该研究发现指出了外泌作用的两个重要作用。首先,外泌作用将激活的TCR从CTLs的膜中移除,当ectosomes被死亡靶细胞吞噬时,终止信号传导。其次,TCR外泌作用允许CTL和靶细胞分离,随着ectosomes从CTL膜上脱落,分离区域自然形成。虽然这些区域在持续的TCR识别靶细胞过程中可能很小,但随着靶细胞识别的停止,外泌作用将允许完全分离和脱离,促进连续杀伤。
该研究展示了激活诱导的膜特化如何在免疫突触内切换生物学功能。这些发现表明,TCR信号传导是自我限制的,通过一个无缝连接受体信号传导和激活TCR的脱落和CTL分离的过程。作者认为,这可能为激活后脱落受体提供了一种通用机制,可能在许多生物系统中使用,包括纤毛。
参考文献:
Stinchcombe JC, Asano Y, Kaufman CJG, Böhlig K, Peddie CJ, Collinson LM, Nadler A, Griffiths GM. Ectocytosis renders T cell receptor signaling self-limiting at the immune synapse. Science. 2023 May 26;380(6647):818-823. doi: 10.1126/science.abp8933. Epub 2023 May 25. PMID: 37228189; PMCID: PMC7614748.