| 概要:今日,国际顶尖学术期刊Nature杂志在线发表了一项来自华人学者的重磅研究。宾夕法尼亚大学医学院的郭巍教授与徐小威教授研究团队合作,报道了癌细胞为了抑制免疫系统,竟会放出“无人机”(携带PD-L1的外泌体)远程干扰免疫细胞的活性!该研究发现提供了对肿瘤免疫逃避的新见解,对当前火热的抗PD-1/PD-L1免疫疗法具有重要指导意义,是迈向精准、个性化医疗的又一大步。 |
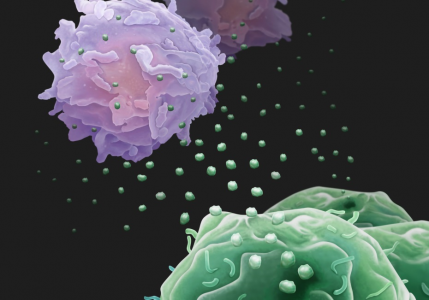
癌症不仅仅是细胞增殖失去控制的问题;它们会与机体内的免疫系统斗争,为自己的生存争取机会。能够逃避免疫系统监视是癌症的特征。来自宾夕法尼亚大学的研究人员发现,为了协助战斗,癌细胞释放生物“无人机”,被称为外泌体的小囊泡,在血液中循环并携带PD-L1蛋白,导致T细胞在到达癌细胞做斗争之前出现“疲劳”。
这项工作发表在Nature杂志上,是宾夕法尼亚大学郭巍教授与徐小威教授之间的合作。虽然主要针对转移性黑色素瘤,但研究小组发现乳腺癌和肺癌也会释放携带PD-L1的外泌体。
该研究为癌症如何采取系统性方法抑制免疫系统提供了范式转换。此外,还提出了一种新方法来预测哪些癌症患者会对某些检查点抑制剂药物产生反应,这些药物会破坏免疫抑制以对抗肿瘤,并且可以追踪这些疗法的有效性。
“许多转移性黑色素瘤患者的免疫疗法可以挽救生命,但这些患者中约有70%没有反应,”郭教授说。“这些治疗费用昂贵并且有毒副作用,因此了解哪些患者会有所反应非常有帮助。识别血液中的生物标志物可能有助于及早预测哪些患者会做出反应,而后可以为患者及其医生提供监测其治疗效果的方法。”
“外泌体是微小的脂质包裹的囊泡,直径小于红细胞的百分之一。我们在这些循环外泌体中的发现确是非常了不起,”徐教授说。“我们收集了用抗PD1检查点抑制剂治疗的黑色素瘤患者的血液样本。这种类型的液体活检检测可以让我们随着时间的推移监测肿瘤相关的免疫抑制。”
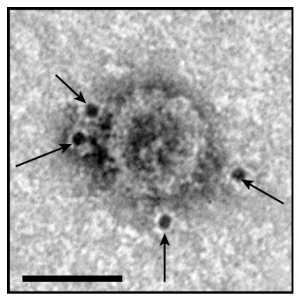
黑色素瘤细胞分泌的携带PD-L1的外泌体
癌症治疗中最成功的创新之一是使用检查点抑制剂药物,这些药物旨在阻止癌细胞抑制免疫系统。这类药物的主要靶标之一是PD-1,一种T细胞表面的蛋白质。肿瘤细胞表达PD-L1,其与PD-1相互作用,有效地关闭该细胞的抗癌反应。使用检查点抑制剂阻断这种相互作用使T细胞重新活跃,使它们能够释放出对癌细胞的杀伤能力。
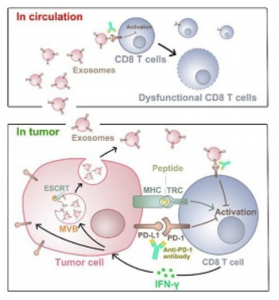
虽然已知癌细胞表面携带PD-L1,但郭教授、徐教授及其同事在新研究中发现,人类黑色素瘤细胞的外泌体也在其表面携带PD-L1。外泌体PD-L1可直接结合并抑制T细胞功能。鉴定肿瘤细胞分泌的外泌体PD-L1为免疫检查点机制提供了重要更新,并提供了对肿瘤免疫逃避的新见解。
“由黑色素瘤细胞分泌的外泌体基本上是一种免疫抑制剂。”郭教授说。“我们提出了一种模型,其中这些外泌体像无人机一样对抗循环中的T细胞,甚至在T细胞接近肿瘤之前。”
由于单个肿瘤细胞能够分泌许多外泌体拷贝,PD-L1外泌体和T细胞之间的相互作用提供了抑制全身抗肿瘤免疫的系统和高效手段。这可能有助于解释为什么癌症患者的免疫系统减弱。
由于外泌体在血液中循环,与传统的、更具侵入性的肿瘤活检相比,它们提供了通过血液检测监测癌症-T细胞“战斗”的可接受方式。经过急性治疗阶段,研究人员设想这样一种测试方法可以监测药物对癌细胞的控制情况。
通过测量PD-L1的治疗前水平,肿瘤学家可能能够预测患者的肿瘤负荷程度并将其与治疗结果联系起来。此外,血液测试可以测量治疗的有效性。例如,外泌体PD-L1的水平可以指示免疫检查点抑制剂对T细胞活化的水平。
“在未来,我认为我们将开始把癌症视为一种慢性疾病,如糖尿病,”郭教授说。“正如糖尿病患者使用血糖仪测量血糖水平一样,监测PD-L1和循环外泌体上的其他生物标志物可能是临床医生和癌症患者密切关注治疗效果的一种方式。这是迈向精准和个性化医疗的又一大步。”
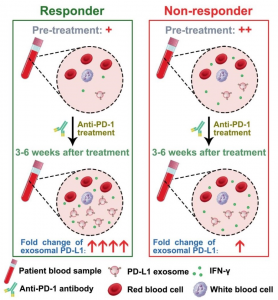
循环外泌体PD-L1的潜在应用预测患者对抗PD-1疗法的反应。循环外泌体PD-L1的治疗前水平在转移性黑素瘤患者中较低,具有对抗PD-1疗法的临床反应。 在抗PD-1治疗3-6周后,循环外泌体PD-L1的水平在临床应答者中显著增加,但在非应答者中没有。
论文摘要:
肿瘤细胞通过上调程序性死亡配体1(PD-L1)的表面表达来逃避免疫监视,其与T细胞上的程序性死亡-1(PD-1)受体相互作用以引发免疫检查点反应。抗PD-1抗体在治疗肿瘤方面显示出很好的前景,包括转移性黑色素瘤。但是,患者的反应率很低。所以需要更好地了解PD-L1介导的免疫逃避,以预测患者反应并提高治疗效果。该研究报道了转移性黑色素瘤释放细胞外囊泡,主要是外泌体形式,在其表面携带PD-L1。用干扰素-γ(IFN-γ)刺激增加了这些囊泡上PD-L1的量,这抑制了CD8 T细胞的功能并促进肿瘤生长。在患有转移性黑素瘤的患者中,循环外泌体PD-L1的水平与IFN-γ的水平呈正相关,并且在抗PD-1疗法的过程中变化。在治疗的早期阶段,循环外泌体PD-L1的增加幅度可作为肿瘤细胞对T细胞更新的适应性反应的指标,从而区分临床应答者与非应答者。该研究揭示了肿瘤细胞系统性抑制免疫系统的机制,并为外泌体PD-L1作为抗PD-1治疗预测因子的应用提供了理论依据。
PD-L1外泌体作用模式图(来自武汉大学口腔医学院官网)
作者简介:
通讯作者:郭巍教授
宾夕法尼亚大学文理学院生物系教授。主要从事细胞迁移、胞吐和癌细胞侵袭等方面的生物学研究。在细胞生物学研究领域取得了一系列显著成就。对调节外泌体的生物发生和分泌的分子机制感兴趣。目标是了解癌细胞衍生的外泌体和其他类型的细胞外囊泡如何与肿瘤微环境和免疫系统进行癌症转移和免疫抑制。
通讯作者:徐小威教授
宾夕法尼亚大学医院病理学和检验医学教授。主要从事解剖病理学、免疫生物学和实验病理学研究,重点关注皮肤干细胞和黑色素瘤。研究皮肤成体干细胞、黑素细胞和黑素瘤生物学,旨在有效治疗白癜风、黄褐斑、黑色素瘤和其他皮肤病。
第一作者:陈刚副教授
武汉大学口腔医学院口腔颌面-头颈肿瘤外科副教授、副主任医师。主要从事细胞外囊泡的基础和应用研究,围绕细胞外囊泡的示踪成像、致病机制及其生物医学应用等方面取得了一系列原创性成果。
郭巍、徐小威和陈刚被列为宾夕法尼亚大学这项工作的专利发明者。
Exo Bio公司获得宾夕法尼亚大学专利许可,郭巍和徐小威在Exo Bio公司担任科学顾问,并拥有股权。
参考资料:宾夕法尼亚大学官网、武汉大学口腔医学院官网等。
参考文献:Chen, G., et al. (2018). "Exosomal PD-L1 contributes to immunosuppression and is associated with anti-PD-1 response." Nature.