溶酶体中诸如铁等金属离子的耗竭是细胞抵御铁死亡的关键机制。在电离辐射损伤等病理状态下,溶酶体铁代谢失调会引发铁死亡,进而导致多组织损伤。然而,如何修复溶酶体缺陷、靶向铁死亡以促进组织修复,仍是尚未解决的挑战,目前缺乏可转化和临床应用的有效方案。
空军军医大学口腔医院的隋秉东副教授和金岩教授带领的团队,长期专注于基于干细胞移植的口颌系统组织再生研究。他们基于发育生物学中基质细胞凝聚的原理,开发了干细胞聚合体(CA)技术,并成功将其应用于临床,实现了年轻恒牙外伤后的全牙髓再生以及牙髓-牙周联合再生支持的完全脱位牙延迟再植。此外,他们还发现了细胞外囊泡(EVs)介导的移植物-宿主交流在再生过程中的关键作用。
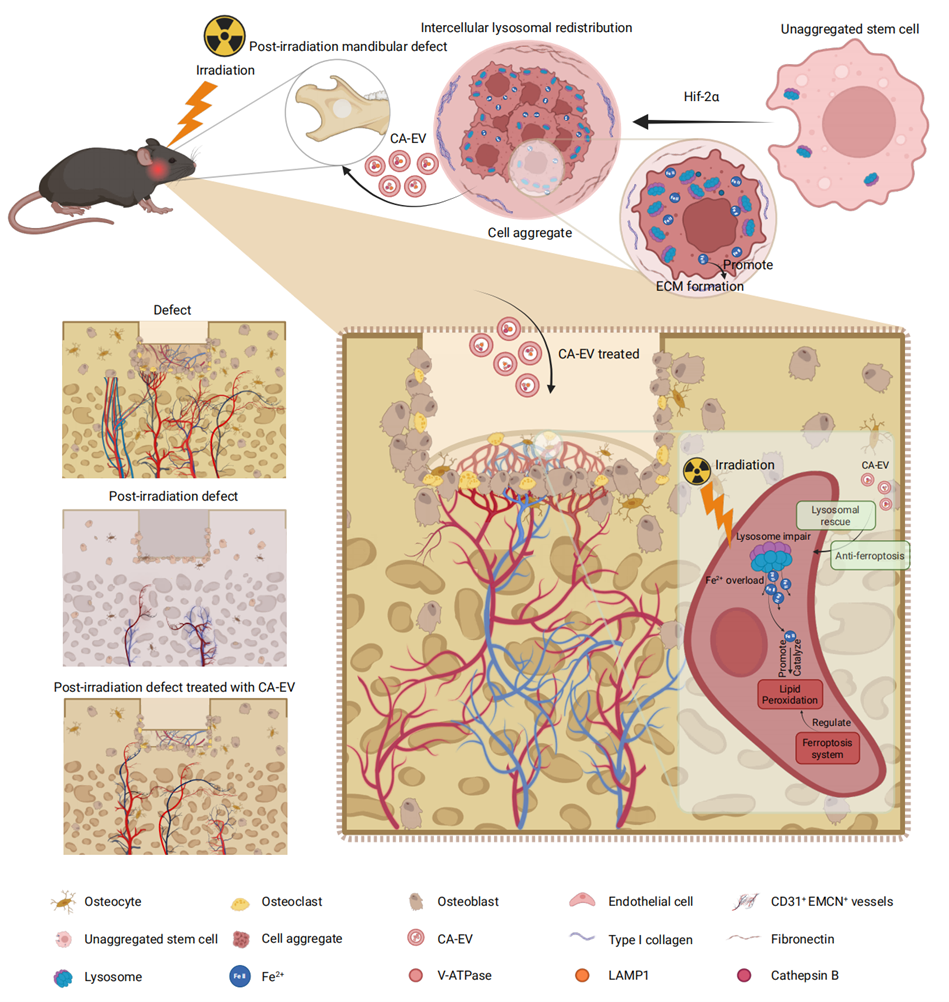
近日,该团队在权威期刊Advanced Science(IF=14.1)上发表了题为“Lysosome-Featured Cell Aggregate-Released Extracellular Vesicles Regulate Iron Homeostasis and Alleviate Post-Irradiation Endothelial Ferroptosis for Mandibular Regeneration”的研究论文。该研究发现,溶酶体在CA内特定区域聚集,通过调控铁稳态来影响CA的形成。这一过程是由缺氧信号驱动、干细胞聚合体源性胞外囊泡(CA-EVs)介导的溶酶体重分布所实现的。研究团队进一步发现,这些具有溶酶体特征的囊泡能够调节铁稳态,修复受体内皮细胞的溶酶体缺陷,恢复铁稳态,减轻铁死亡,从而增强内皮细胞对辐射损伤的抵御能力。更为重要的是,体内实验结果显示,CA-EVs治疗可促进CD31+endomucin+血管的生长,并加速辐射后下颌骨缺损的骨再生。这些发现表明CA-EVs有望作为一种天然治疗剂,保护溶酶体功能,调节铁代谢,抵御铁死亡,为辐射引起的内皮损伤和组织再生障碍提供新的治疗途径。
电离辐射可诱导铁死亡,这是一种以铁积累和脂质过氧化为特征的受调控细胞死亡形式,在辐射所致骨损伤中起着关键作用,会阻碍骨组织再生。因此,靶向铁死亡为改善电离辐射引起的骨愈合和再生不良提供了潜在的治疗策略。该研究首次揭示了溶酶体重分布对于维持细胞间铁平衡的重要性,具有溶酶体特征的CA-EVs参与了这一过程的调控,这一发现丰富了我们对EVs与溶酶体相互作用的认识。该研究证实,CA-EVs能够修复辐射引起的溶酶体损伤,恢复受体细胞铁稳态,并调节内皮细胞铁死亡通路。体内实验表明,CA-EVs不仅能促进辐射损伤组织的血管再生,还能减轻辐射后下颌骨缺损中的铁死亡,凸显了其作为铁死亡相关疾病治疗策略的潜力。
该研究不仅阐明了溶酶体在干细胞聚合和铁死亡中的调控作用,更证实了CA-EVs通过修复细胞器功能障碍逆转铁死亡的治疗潜力,为EVs的临床转化应用提供了坚实的理论基础和实验依据。
在该研究中,空军军医大学隋秉东副教授为该论文的主通讯作者,李源媛博士为论文的第一作者。论文致谢国家重点研发计划(2022YFA1104400)等项目支持。课题组团队长期致力于干细胞及其衍生物在组织再生中的应用研究,在相关领域已获得国家科技进步一等奖1项,省部级科学技术一等奖5项,相关成果2次入选中国生命科学十大进展。团队长期欢迎优秀研究生报考,以及博士后、科研助理加入团队,有意向可发送简历至隋秉东老师(bingdong1221@163.com)。
参考文献:
Lysosome-Featured Cell Aggregate-Released Extracellular Vesicles Regulate Iron Homeostasis and Alleviate Post-Irradiation Endothelial Ferroptosis for Mandibular Regeneration. Adv Sci. 2025, e05070. https://doi.org/10.1002/advs.202505070
外泌体资讯网 Adv Sci|空军军医大学口腔医院隋秉东/金岩团队:干细胞聚合体释放的溶酶体赋能囊泡可缓解铁死亡并促进颌骨再生





