活细胞分泌的外泌体含有大量蛋白质和核酸分子信息,具有高稳定性。此外,区分来自不同细胞系的外泌体表面蛋白质标志物的微妙变化有助于了解外泌体的异质性以及相关癌症的信息。因此,外泌体蛋白可作为一种用于癌症诊断的新型无损的诊断生物标志物。
2021年12月16日,来自复旦大学化学系孔继烈教授、陈惠副教授的研究团队构建了一种基于纳米金(AuNPs)和非共轭聚合物点(Pdots)之间的局部表面等离子体共振(LSPR)的增强型化学发光(ECL)免疫传感器用于胰腺癌外泌体超灵敏检测,并提出了该模式下LSPR的可能性机制。同时该团队发现利用该平台可以实现癌症相关的外泌体蛋白标志物表达谱分析。相关内容以“Surface plasmon coupling electrochemiluminescence immunosensorbased on polymer dots and AuNPs for ultrasensitive detection of pancreaticcancer exosomes”为题发表在ACS旗下AnalyticalChemistry杂志上 (DOI: 10.1021/acs.analchem.1c03535)。本文第一作者为复旦大学化学系研究生熊桧文。

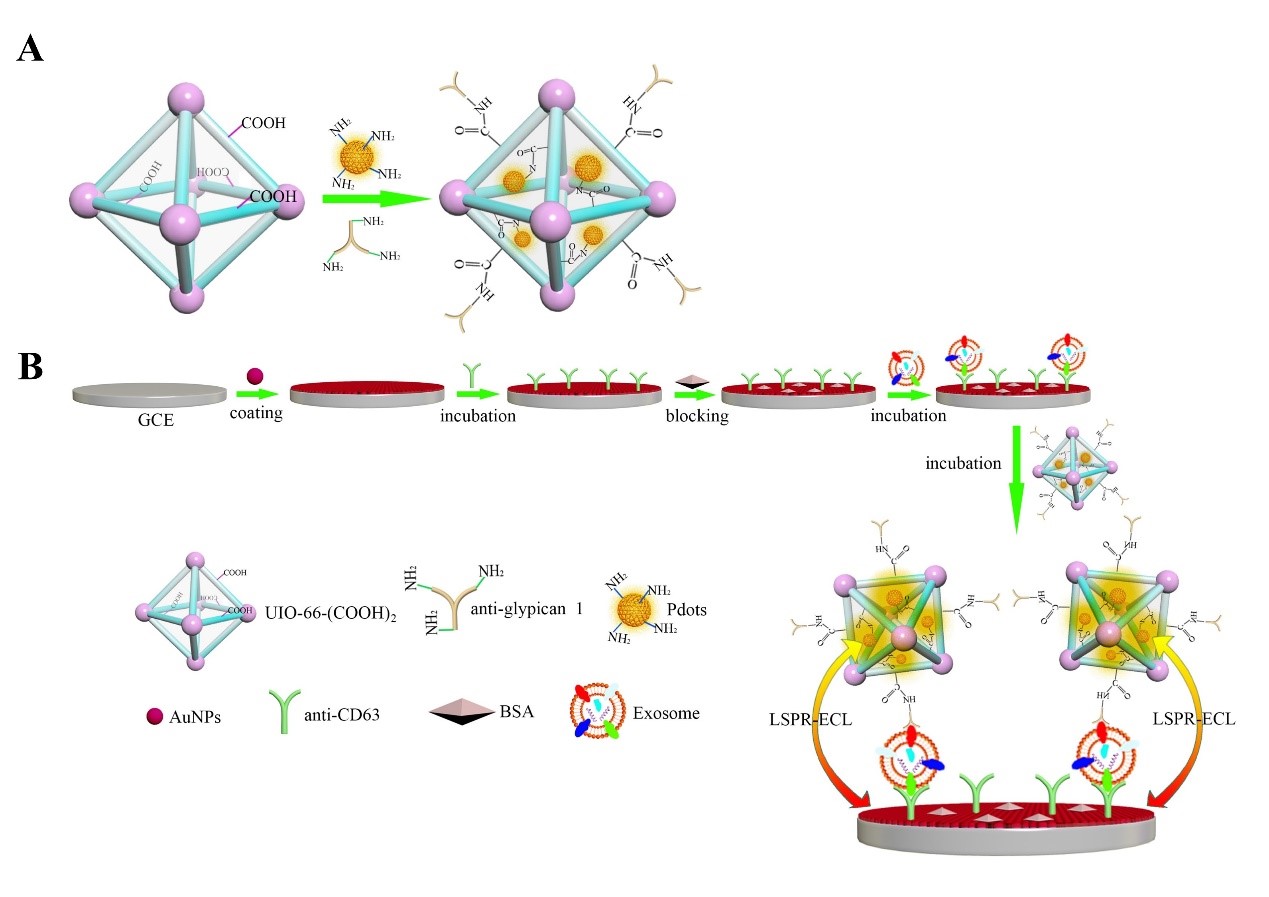
该研究首先将一种Pdots应用于ECL领域,发现其具有易修饰和稳定的电化学、光学性能等特点,但由于它们的ECL效率较低,不足以满足实际应用需求。为提高检测灵敏度,该课题组基于纳米金(AuNPs)和Pdots之间的局部表面等离子体共振(LSPR)作用设计了一种用于胰腺癌外泌体超灵敏检测的ECL免疫传感器,结果发现ECL信号在LSPR作用下明显放大。
图1 等离子体共振电化学发光传感器示意图
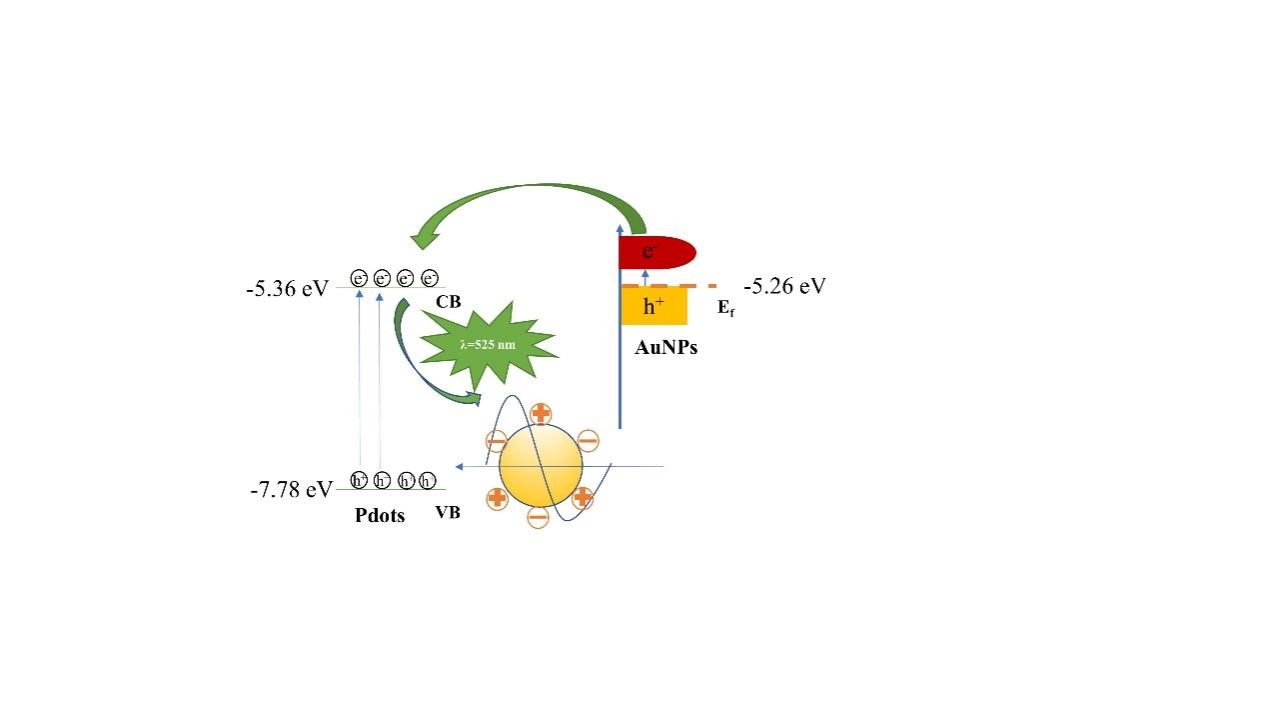
根据Pdots和AuNPs的能带结构,探讨了LSPR的可能性机制。由于Pdots的ECL光谱和AuNPs的紫外吸收光谱明显重叠,AuNPs的热电子由Pdots的ECL发射激发,随后将激发的热电子传递到Pdots的导带(CB),从而显著提高了Pdots的ECL效率。
图2 LSPR-ECL增强可能性机制
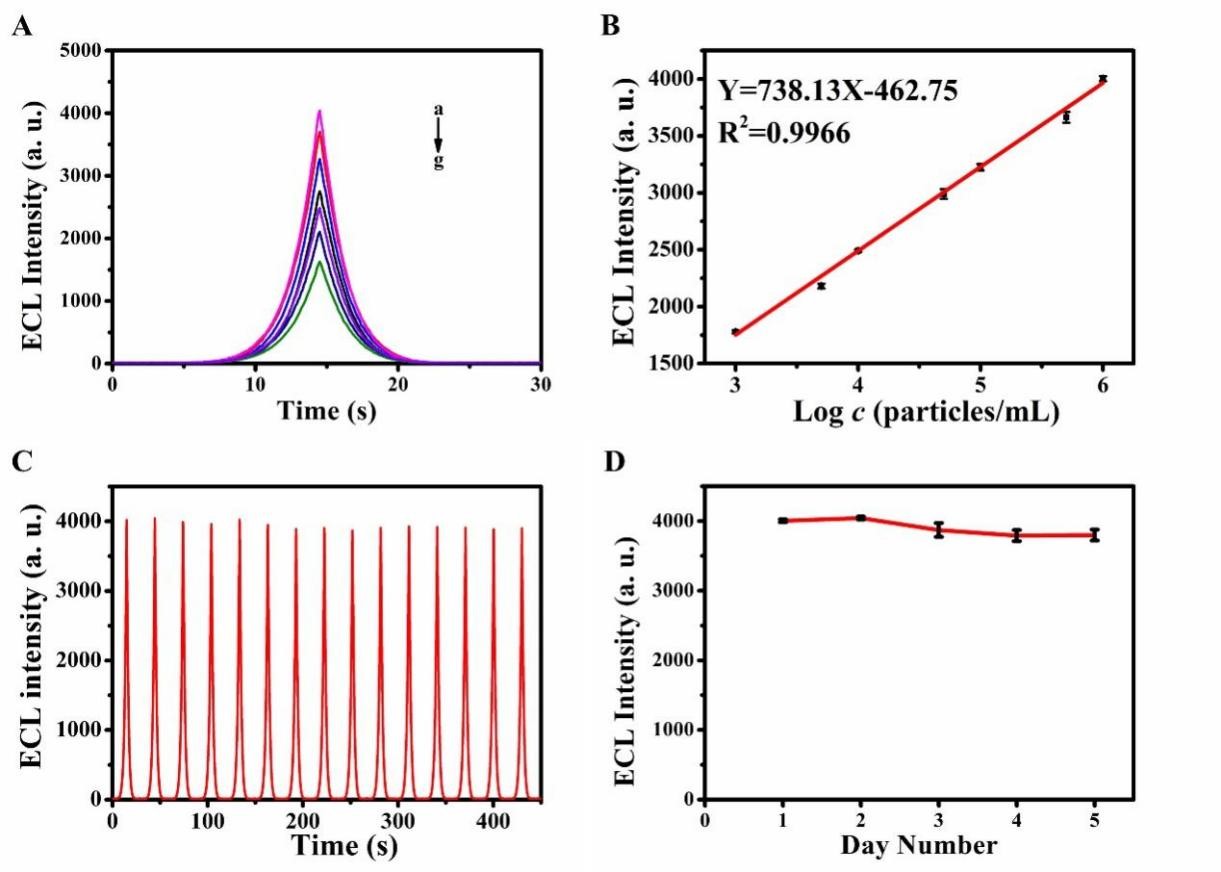
进一步将该传感器应用于胰腺癌外泌体检测,证实该三明治夹心ECL免疫传感器线性范围为1.0×103 ~1.0×106particles/mL,检测限为400 particles/mL。15个循环的稳定性RSD为1.34%,连续五天测试的重现性RSD为2.50%。
图3 LSPR-ECL传感器的分析性能
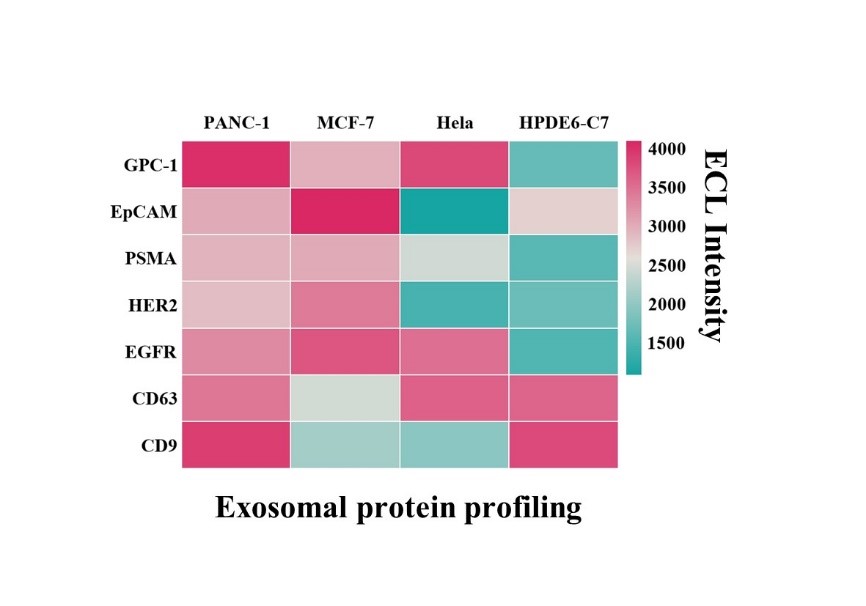
癌症相关的外泌体蛋白标志物表达谱分析显示出PANC-01,HELA,MCF-7,和HPDE6-C7细胞系外泌体表面蛋白的不同表达量的高选择性。该ECL免疫平台表现出外泌体表面蛋白生物标志物分析和早期癌症相关诊断的应用前景。
图4 不同细胞系来源外泌体的蛋白表达谱分析
综上,该研究结果表明,该等离子体共振电化学发光传感模式有望实现胰腺癌早期诊断和预测。
参考文献:
Surface Plasmon CouplingElectrochemiluminescence Immunosensor Based on Polymer Dots and AuNPs for UltrasensitiveDetection of Pancreatic Cancer Exosomes. Anal Chem. 2021 Dec 16. doi:10.1021/acs.analchem.1c03535.
外泌体资讯网 AnalyticalChemistry: 基于聚合物点和纳米金的表面等离子体耦合电化学发光免疫传感器用于胰腺癌外泌体的超灵敏检测