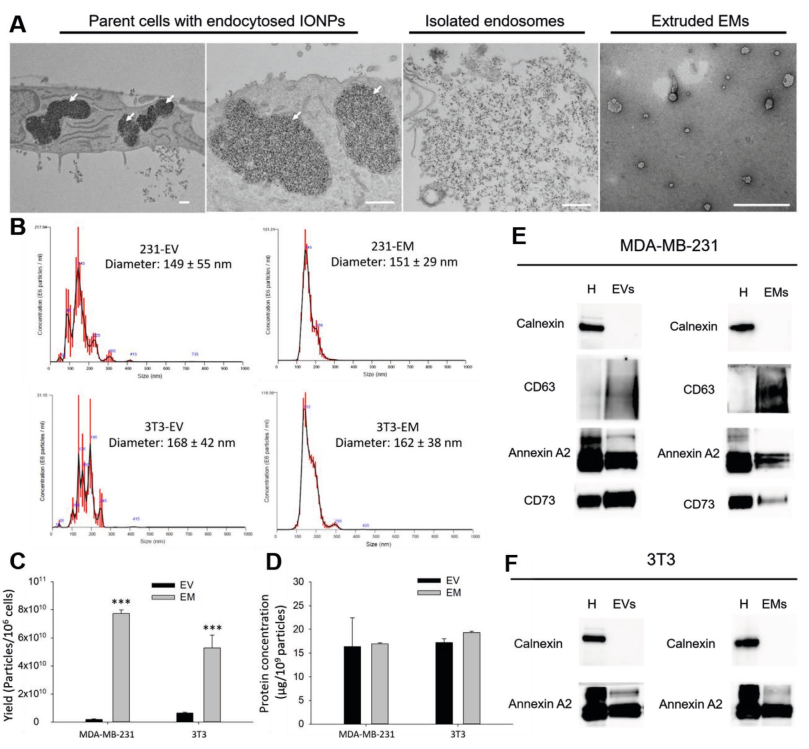
泌体的放大生产和有效载药是限制基于外泌体的药物递送临床转化的两个现有挑战。来自哈佛大学波士顿儿童医院的研究人员开发了一种简便的磁性挤压方法,用于制备内体衍生的囊泡,也称为外泌体模拟物(EM),与天然外泌体具有相同的生物学起源和相似的形态、组成和生物功能。这种磁性挤压方法的高产量和一致性有助于克服外泌体研究中的制造瓶颈。
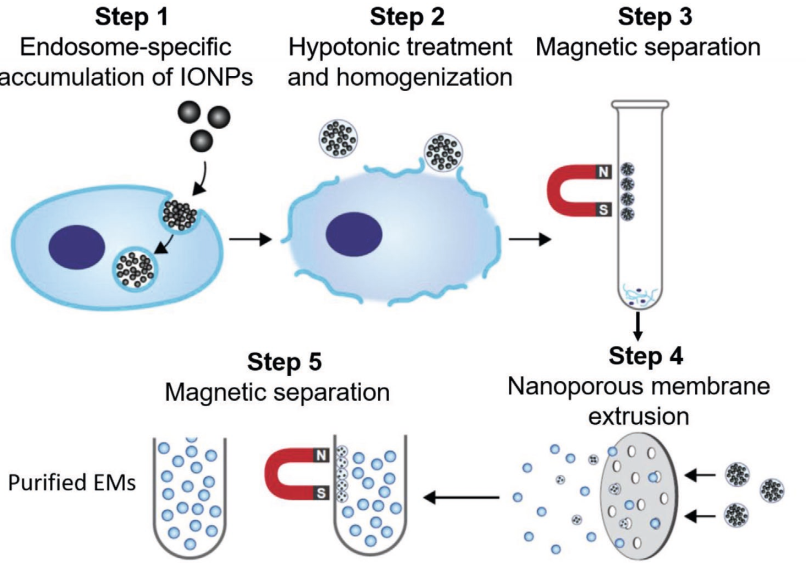
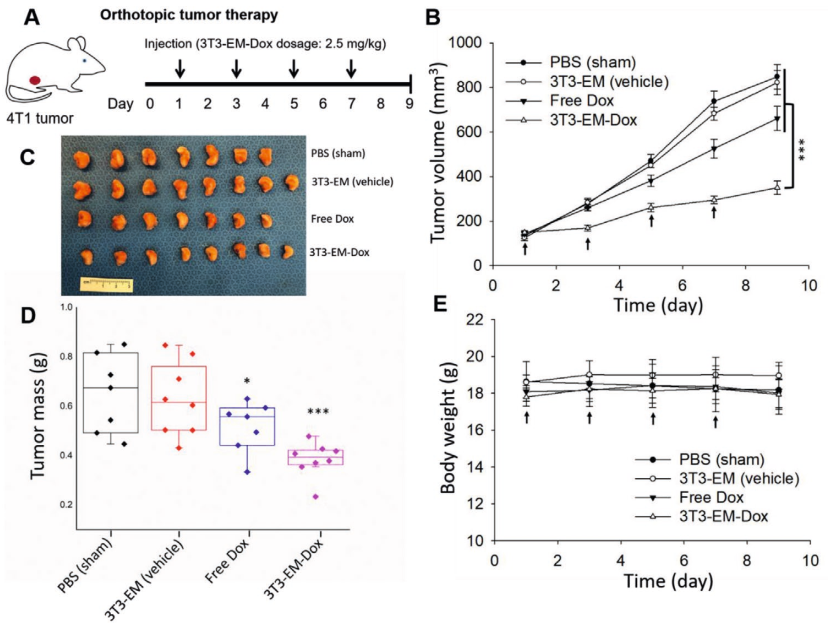
该研究所提出的标准化多步骤方法很容易促进硫酸铵梯度方法将化学药物(如阿霉素)主动加载到EM中。该研究开发和测试的工程化EM表现出与天然外泌体相当的药物递送特性,并通过在原位乳腺肿瘤模型中递送阿霉素来有效抑制肿瘤生长。磁力挤压法示意图。第1步:IONPs通过内吞作用被内化到内体中。第2步:通过低渗处理和均质化释放封装IONP的内体。第3步:通过磁分离将包裹IONP的内体与其他细胞器和细胞碎片分离。第4步:通过纳米多孔膜挤出将封装IONP的内体挤出成单分散的EM。步骤5:使用磁分离从不含IONP的EM中去除封装IONP的EM。外泌体是由大多数细胞类型分泌的内体来源的纳米级细胞外囊泡(EVs,30-150nm)。外泌体的异质结构特点是脂质双层包裹生物活性物质,主要是蛋白质和核酸。分泌后,外泌体长距离传播并将其内容物输送到靶细胞,从而在细胞间通讯中发挥关键作用,并支持生理过程(如凝血)和病理过程(如癌症转移)。近年来,外泌体已成为一类新型的多功能纳米颗粒。事实上,外泌体在组成中反映了分泌细胞,因此代表了诊断和预后生物标志物的新来源。此外,由于其独特的结构,外泌体可以很容易地设计并装载各种治疗剂,构成一个有前途的类别用于靶向药物递送的生物相容性载体。作为递送载体,外泌体自然地结合了生物学功能的独特特征,例如器官趋向性、穿过生物屏障和较低的免疫原性,并且可以胜过大多数目前可用的合成纳米颗粒(例如脂质体和聚合物纳米颗粒)。尽管具有潜力,但基于外泌体的疗法的临床转化仍受到严峻挑战,包括可扩展性差的分离方法、有限的产量和低载药效率。传统的外泌体分离方法依赖于时间和劳动密集型方法(例如,超速离心、密度梯度、尺寸排阻色谱),需要昂贵的仪器和训练有素的人员。使用传统方法(例如超速离心、基于聚合物的沉淀和尺寸排阻色谱)分离的外泌体可能会受到不同程度的颗粒聚集、杂质、样品损失和损坏的影响。此外,常规外泌体分离方法,尺寸排阻色谱、超速离心和切向流过滤的产量分别为≈7×107、6×108和1×1010颗粒/百万细胞。这些外泌体分离方法的产量尚未满足基于外泌体的药物递送和诊断应用快速增长的需求。与合成纳米药物相比,常见的外泌体加载策略(例如,被动混合、电穿孔、外源加载)通常加载效率低(<30%)。这些因素和其他因素对用于药物输送目的的外泌体制造规模化提出了重大挑战,如果克服这些挑战,可以将其转化为纳米药物。为了实现这一点,该研究开发了一种新的磁性挤出方法,以一种简便和放大的方式生成内体衍生囊泡的方法。使用氧化铁纳米颗粒(IONP)辅助的磁分离从不同细胞来源收集内体,然后使用纳米多孔膜将内体挤出成单分散的内体衍生囊泡。鉴于获得的内体衍生囊泡与天然外泌体具有相同的细胞内来源,研究人员将它们称为外泌体模拟物(exosome mimetics, EMs)。研究将EM特性和体外/体内性能与从相同细胞系的条件培养基中分离的小型EV的性能进行了比较。利用该方法的可控程序,能够轻松地使用硫酸铵梯度方法以高效的方式将化疗药物阿霉素主动加载到EM中。与天然小EV相比,装载多柔比星的工程化EM(EM-Dox)被评估为一种新型癌症纳米药物,并在体外和体内确定和比较了它们的药物递送性能。装载多柔比星的工程化EM(EM-Dox)的治疗效果这些发现表明,EMs可以通过简单和放大的方式制备,是一种有前途的用于癌症药物递送的生物纳米药物。GuoP, Busatto S, Huang J, Morad G, Moses MA. A facile magnetic extrusion methodfor preparing endosome-derived vesicles for cancer drug delivery. AdvFunct Mater. 2021 Oct 26;31(44):2008326. doi:10.1002/adfm.202008326. Epub 2021 Jan 20. PMID: 34924915; PMCID: PMC8680268.外泌体资讯网 哈佛团队开发出一种简便磁性挤压方法制备内体衍生囊泡用于药物递送