间充质干细胞(mesenchymalstem cell, MSC)在组织修复和再生中发挥重要作用。已有研究表明,低氧预处理的 MSCs 能显著提高体外细胞存活、增殖和血管生成相关的生长因子的表达水平。嗅黏膜间充质干细胞(OM-MSCs) 是一种位于嗅觉固有层的新型常驻干细胞,具有高增殖率、自我更新和多能分化的能力。OM-MSCs 在缺血性脑卒中的治疗中可以发挥积极的作用。但将干细胞直接应用于临床治疗时仍存在可能形成肿瘤、血栓等诸多风险。胞外囊泡是细胞主动分泌到胞外的有膜小泡(EV),可以携带 miRNA、mRNA和蛋白质等物质,传递给受体细胞,起到细胞间通讯的作用。
近日,来自中南大学湘雅二医院胡治平教授团队,以及湖南师范大学卢明教授、陈平教授团队的研究人员重点研究了 OM-MSC-EV 对血管生成的影响及其机制,并在 Journal ofNanobiotechnology发表了题为“Extracellular vesicles derivedfrom hypoxia-preconditioned olfactory mucosa mesenchymal stem cells enhanceangiogenesis via miR-612”的研究论文(2021,19:380)
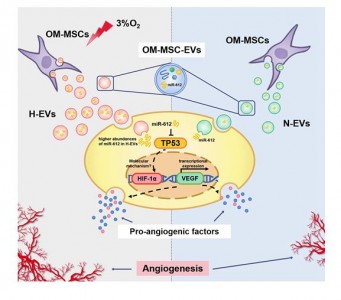
该研究发现从常氧和低氧预处理的OM-MSC 细胞上清中分离的细胞外囊泡 H-EV(低氧环境外囊泡)和 N-EV(常氧环境外囊泡),都能促进人脑微血管内皮细胞(HBMECs)的增殖、迁移和血管生成活性。从机制上讲,H-EV 携带 miR-612 至靶细胞,结合在靶细胞内TP53 mRNA 的 3’-UTR区域抑制其表达,进而通过促进 HIF-1α和 VEGF 表达,以调控内皮细胞血管生成。低氧预处理的 OM-MSC-EV 可能是一种通过 miR-612 转移促进血管生成的有潜力的缺血性疾病治疗策略。
该成果首次表明低氧预处理的嗅黏膜间充质干细胞的细胞外囊泡可以显著促进血管生成;且miR-612 可能在H-EV 依赖的血管生成调控过程中发挥重要作用。EV 是 OM-MSC 功能的重要介质,有望作为一种新纳米给药系统用于缺血性疾病治疗。因此,MSC-EV的低氧预处理为临床使用干细胞来源的产品治疗缺血性疾病提供了一种新策略。胡治平教授与卢明教授、陈平教授团队多年来一直从事OM-MSC的研究,至今已发表了多篇论文。OM-MSCs常驻于嗅黏膜固有层,具有高增殖率、自我更新和多能分化的能力,可自体移植,避免免疫排斥反应和伦理问题,具有广阔的临床应用前景。希望OM-MSCs及其细胞外囊泡可成为治疗缺血性血管性疾病,如脑梗死的潜在药物,为患有缺血性血管疾病患者带来曙光。
参考文献:
Extracellular vesicles derived from hypoxia-preconditionedolfactory mucosa mesenchymal stem cells enhance angiogenesis via miR-612. JNanobiotechnology, 2021 Nov 21;19(1):380.
外泌体资讯网 Journal of Nanobiotechnology: 低氧预处理嗅黏膜间充质干细胞通过胞外囊泡介导血管生成的分子机制