噬介导了细胞器和蛋白质运转、细胞质量控制和新陈代谢,然而,自噬机制也通过非常规分泌途径,例如控制着内体相关的分泌途径和细胞外囊泡(EV)的分泌。肿瘤细胞释放更多的 EV,自噬抑制剂对EV分泌的影响在抗肿瘤治疗中价值巨大。近日,来自的研究人员在Molecular Cancer杂志上发表综述,讨论了不同的自噬抑制剂如何影响EV的分泌,并总结了自噬抑制剂的非特异性作用,重点关注了内体相关的分泌途径。
自噬是一种高度进化保守的机制,在维持细胞器和蛋白质周转、细胞质量控制和新陈代谢中非常重要。溶酶体介导的自噬性降解通过消化细胞质内的物质从而提供营养和能量来源,并用于清除有毒蛋白质聚集体和有缺陷的细胞器。这种再循环途径还可以影响细胞特化和分化、蛋白质运输和非常规分泌途径。在哺乳动物细胞中观察到三种类型的自噬:巨自噬、微自噬和分子伴侣介导的自噬。在微自噬期间,溶酶体膜直接分隔自噬货物;而在巨自噬期间,形成称为自噬体的双膜结构,将自噬货物输送到内体或溶酶体。巨自噬还参与线粒体自噬、核自噬或外噬过程中细胞器的特定降解。伴侣介导的自噬涉及通过伴侣蛋白HSC70和其他辅助伴侣蛋白(例如 CHIP、HOP 和HSP40),提供给溶酶体KFERQ样基序蛋白进行选择性降解。货物进入溶酶体的内化是通过受体溶酶体相关膜蛋白 2A (LAMP2A)来控制的。在这篇综述文章中,研究人员的重点是关注巨自噬。内吞作用是细胞可以通过将物质吞噬在囊泡中来,从而将外部环境中的物质与细胞成分隔离开来。内吞作用包括网格蛋白依赖性途径以及网格蛋白非依赖性途径,例如吞噬作用、胞饮作用、筏介导的内吞作用和ARF6依赖性内化作用。除了自噬,内吞作用最终会导致溶酶体降解,但此时货物是由质膜内化的,而不是从细胞质。内化后,货物按早期内体(early endosomes,EE)的高度动态区室进行分类,以独特的衔接蛋白、效应蛋白和小Rab GTP酶为标志,如RAB4、RAB5、EEA1、VPS34和SNAREs。EEs 是主要的细胞分选平台,因为它们可以成熟为用于各种细胞命运的内体。EE 货物可以通过循环内体循环到质膜,通过逆向复合体运输到高尔基体或从高尔基体运输,或通过多泡体(MVB)/晚期内体进入溶酶体。自噬和内吞途径在某些阶段相互合作介导着许多分子机制。
最近的研究还表明,自噬、外泌体/自噬内涵体(amphisome)和细胞外囊泡(EV)的胞吐作用之间存在许多相互关联。为了释放外泌体/或内涵体,需要执行几个步骤,例如MVB中腔内囊泡(ILV)的生物发生、MVB向自噬体或质膜的转运以及MVB与质膜的融合。这些步骤受自噬机制分子的影响,包括许多Rab GTP 酶,如RAB7、RAB11、RAB35、RAB27A、RAB27B和VAMP7。RAB7和RAB11也参与自噬体形成,RAB7在自噬体成熟中起关键作用。因此,自噬可以对细胞外囊泡(EV)的分泌产生刺激或抑制作用,这些作用可能与环境密切相关。这可以解释自噬在癌症进展中的双刃剑特性。在这篇综述文章中,研究人员讨论了不同的自噬抑制剂如何影响EV的分泌,并总结了自噬抑制剂的非特异性作用,重点是内体相关的分泌途径。自噬的调节不仅会显著影响EV的数量,还会显著影响它们的内容物含量,这对用于实体癌抗肿瘤治疗的自噬抑制剂的促肿瘤或抗肿瘤作用带来的影响。
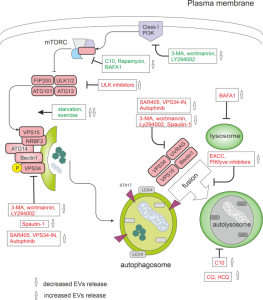
图:自噬调节剂及其对 EV 释放的影响。在营养丰富的条件下,mTORC1阻断ULK复合物和自噬。mTORC1 信号可以被C10、雷帕霉素、运动或饥饿直接抑制。ULK复合体激活VPS34 复合体。VPS34是III类磷脂酰肌醇3-磷酸激酶(PI3KC3)。PI3K 抑制剂,包括3-甲基腺嘌呤 (3-MA)、wortmannin和LY294002,可抑制PI3K。VPS34抑制剂包括Spautin-1、autophinib、SAR405和VPS34-IN1。Autophinib是VPS34的 ATP竞争性抑制剂,可减少脂化蛋白LC3在自噬体膜上的积累。自噬机制的后期阶段包括融合和降解。在融合过程中,成熟的自噬体与溶酶体融合,形成自噬溶酶体。磷酸肌醇激酶PIKfyve抑制剂和 EACC 阻断自噬体-溶酶体融合。BAFA1 通过阻断V-ATPase来抑制自溶酶体的酸化,而氯喹(CQ)和3-羟基氯喹 (HCQ) 会损害自溶酶体的成熟。图中激活作用标记为绿色,抑制作用为红色。参考文献:Crosstalk between autophagy inhibitors and endosome-relatedsecretory pathways: a challenge for autophagy-based treatment of solid cancers.Mol Cancer. 2021 Oct 27;20(1):140.外泌体资讯网 【综述】Mol Cancer:自噬抑制剂与细胞外囊泡分泌间联系及其在肿瘤治疗中的挑战