细胞外囊泡(EVs)是生物纳米颗粒,在细胞间通讯中具有重要作用,并具有作为药物递送载体的潜力。近日,牛津大学的研究人员在Nature Communications杂志上发表文章,报道了糖酵解酶甘油醛-3-磷酸脱氢酶(GAPDH)在EV组装和分泌中的作用。研究观察到高水平的GAPDH通过磷脂酰丝氨酸结合基序(G58)与EV的外表面结合,这促进了广泛的EV聚类。果蝇EV生物发生模型的进一步研究表明,内体区室中腔内囊泡的正常产生需要GAPDH,并促进囊泡聚集。GAPDH衍生的G58肽与dsRNA结合基序的融合能够高效地将小干扰RNA(siRNA)加载到EV表面。在全身注射后,这种囊泡可将siRNA有效地传递到亨廷顿病小鼠模型大脑的多个解剖区域,导致大脑不同区域的亨廷顿基因沉默。细胞外囊泡(EV)正在成为细胞间通讯的重要介质,细胞可以通过它以脂质、蛋白质或核酸的形式交换信息。EVs是脂质双层封闭的纳米级颗粒,包含来自母细胞的膜相关蛋白和细胞溶质成分。有几类EVs,但直径为30-150nm的小型EVs是研究最多的。它们作为在细胞内内体区室中形成的外泌体或作为从细胞表面脱落的微泡由细胞分泌。鉴于其独特的生物学和药理学特性,EVs作为生理和病理生理过程的介质引起了人们的兴趣,并且具有作为无细胞疗法的潜力。据报道,EV在调节免疫反应、癌细胞转移、神经退行性疾病中涉及的致病蛋白的传播中发挥重要作用,并且正在成为各种疾病的生物标志物来源。尽管EV的异质性使其分子特征变得复杂,但近年来我们对其生物发生的理解取得了重大进展。外泌体和微泡生物发生的多种机制已被确定,涉及ESCRT依赖和ESCRT非依赖过程。已确定参与这些过程的多种细胞成分包括Alix、TSG101、syndecan-syntenin复合物、四跨膜蛋白家族和脂筏。然而,我们仍然缺乏对所涉及的调节和装载过程的详细了解。EVs作为药物输送的潜在载体也引起了相当大的兴趣,特别是作为非编码RNA和蛋白质等大分子的载体。它们的免疫惰性和穿越生物屏障的能力是可用于治疗应用的两个重要特征。EVs已被证明可以在多种治疗环境中提供治疗性小干扰RNA(siRNAs)和反义寡核苷酸,包括在小鼠模型中抑制胰腺癌、恢复肌营养不良蛋白表达用于治疗肌营养不良症。然而,对EV生物发生和吸收机制的不完全了解以及缺乏有效的载药方法仍然是需要解决的关键挑战。目前将治疗分子加载到EV中的方法,如电穿孔、宿主细胞基因工程和化学偶联,受到低效率、毒性和缺乏可扩展性的限制。此外,它们产生了异质性的EVs群体,在理解EVs在靶细胞中的表型效应方面产生了进一步的复杂性。开发将EV的自然特性用于治疗应用的方法可能会为这个问题提供更可靠的方法。在过去的二十年中,对甘油醛-3-磷酸脱氢酶(GAPDH)(传统上称为“看家”蛋白)的研究揭示了细胞过程中的多种功能,这些功能与其在糖酵解中的典型作用无关。早期研究表明,GAPDH是一种核酸结合蛋白,可防止端粒DNA快速缩短,参与tRNA和mRNA的转运,通过与mRNA的5'UTR和3'UTR的特异性结合来调节基因的表达,并具有参与修复受损DNA的尿嘧啶DNA糖基化酶活性。GAPDH还是细胞对氧化应激反应的关键介质。在低氧化应激下,GOSPEL(GAPDH’s competitor of Siah protein enhanceslife)保留了GAPDH的糖酵解功能并防止其S-亚硝基化。高氧化应激水平诱导GAPDH的S-亚硝基化,导致其与Siah相互作用和随后的核易位,导致核蛋白泛素化和降解,引发细胞凋亡。最近的报道揭示了GAPDH在预防癌细胞中非半胱天冬酶非依赖性细胞死亡(CICD)方面的复杂而矛盾的作用。GAPDH的过表达稳定了活性Akt,进而导致抗凋亡Bcl-xL的过表达,从而保护线粒体通透化。GAPDH还参与自噬蛋白ATG12的上调,该蛋白增强自噬并清除受损的线粒体,防止CICD,进而导致细胞的克隆性生长。此外,GAPDH的多种生理作用还涉及多种神经系统疾病。GAPDH已被确定为阿尔茨海默病淀粉样蛋白斑块的主要成分,并且已知与淀粉样蛋白-β蛋白前体相互作用。突变亨廷顿蛋白的扩增聚谷氨酰胺重复序列已被证明与GAPDH相关,可能会破坏GAPDH介导的受损线粒体向溶酶体系统的运输。GAPDH的功能多样性归因于其寡聚性质、翻译后修饰和区室化,使其能够与不同的蛋白质相互作用。GAPDH是与EV相关的最丰富的蛋白质之一,据报道它与EV外膜结合,在那里它与铁结合蛋白转铁蛋白(transferrin)和乳铁蛋白(lactoferrin)相互作用,并将它们从组织培养基输送到细胞中。最近,已经观察到GAPDH在腔内囊泡形成过程中与外泌体相关联,并且外泌体的胞吐作用代表了细胞分泌GAPDH的一种途径,当细胞耗尽铁时,这一过程会增强。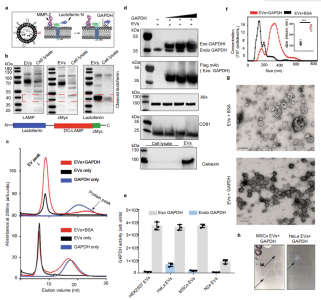
该研究表明GAPDH通过磷脂酰丝氨酸结合基序(G58)与EV结合,并且将外源性GAPDH添加到EV制剂中会诱导EV聚集。对循环内体隔室中外泌体生物发生的体内果蝇模型的分析表明,内源性GAPDH参与外泌体聚集和多囊泡内体中中央致密颗粒的形成,并且还影响外泌体的形成和分泌。此外,缺乏聚类活性但与RNA结合域融合的嵌合EV结合蛋白(G58)显示出促进siRNA加载到EV表面并在培养细胞和小鼠亨廷顿氏病模型中表现出增强的基因沉默活性。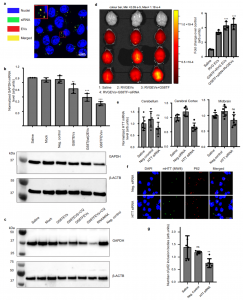
GAPDH衍生的G58肽促进EV介导的siRNA递送至大脑DarGH, Mendes CC, Kuan WL, Speciale AA, Conceição M, Görgens A, Uliyakina I, LoboMJ, Lim WF, El Andaloussi S, Mäger I, Roberts TC, Barker RA, Goberdhan DCI,Wilson C, Wood MJA. GAPDH controls extracellular vesicle biogenesis andenhances the therapeutic potential of EV mediated siRNA delivery to the brain.Nat Commun. 2021 Nov 18;12(1):6666. doi:10.1038/s41467-021-27056-3. PMID: 34795295; PMCID: PMC8602309.外泌体资讯网 Nature子刊:GAPDH调控细胞外囊泡生物发生,增强EV介导siRNA递送至大脑的治疗潜力


