T细胞的基因修饰推动了细胞免疫疗法的发展,但是将生物制品专门递送到T细胞仍然具有挑战性。近日,来自美国西北大学的Joshua N Leonard研究组在Nature Biomedical Engineering杂志上发表文章,报告了一套方法,用于基因工程细胞产生细胞外囊泡(EV),这些囊泡自然地封装和转移细胞之间的蛋白质和核酸,以实现对T细胞的生物制品的定向递送,而无需进行化学修饰。
CRISPR-Cas9介导的人类T细胞基因组工程是治疗癌症、自身免疫和传染病的活跃研究领域。将可编程核酸酶Cas9和与目标序列互补的sgRNA一起递送,会导致引入双链断裂,从而在编码基因中引入移码突变并消除蛋白质表达。或者,共递送同源重组修复模板可以将指定的突变、插入或删除插入到目标细胞的基因组中。虽然这项技术有多种应用,但由于在体内递送Cas9的挑战,该策略的转化仍然很困难。一种利用基础基因治疗进展的方法是腺相关病毒(AAV)载体,尽管安全性和有效性通常受到抗载体免疫和有限的组织靶向性的限制。类病毒颗粒也可以递送Cas9核酸酶或碱基编辑器,尽管病毒蛋白的免疫原性是否同样会限制这些方法仍不清楚。合成纳米颗粒-核酸(例如mRNA)递送是病毒载体的替代方法,已用于体内递送mRNA,以在小鼠T细胞中提供嵌合抗原受体的持续表达。然而,以一种能够赋予Cas9短暂表达以避免非靶向效应的方式实现高效的T细胞靶向仍然具有挑战性。这些一般困难与向T细胞递送任何载荷的挑战相结合,T细胞显示出低的内吞作用率。总之,存在大量机会来改进递送系统,从而使生物制品能够在患者的T细胞内递送。
一种有前途的新兴策略是使用细胞外囊泡(EV)递送生物分子载荷。EV是由所有细胞分泌的纳米级、膜包裹的颗粒,在生物发生过程中自然地封装蛋白质和核酸。EV介导细胞间通信,将其内容传递给受体细胞以影响细胞功能。固有的非毒性和非免疫原性,以及工程表面和腔内货物装载的能力,使EV成为递送广泛药物的有吸引力的载体。货物可以通过在生产细胞中过表达,使其在EV生物发生过程中被装载,或通过在收集后物理或化学修饰囊泡来纳入囊泡中。甚至可以植入基因工程的细胞以持续产生这种颗粒。虽然收集后修改EV可以赋予货物装载的灵活性,但这种方法需要更繁杂的纯化,并从制造和监管的角度引入挑战。
最近的几项研究调查了使用EV递送Cas9治疗癌症、乙型肝炎和遗传疾病的情况,突出了这种方法在实现细胞内Cas9传递方面的潜力。然而,许多探索性研究使用已知会在下游实验中引入人工物的EV工程方法,这使得功能效应如何归因于EV变得模糊。特别值得关注的是,依赖于将EV生产细胞转染脂质体、使用电穿孔方法装载EV或使用商业试剂盒分离EV的方法,这些方法都已被证明会引入人工物。
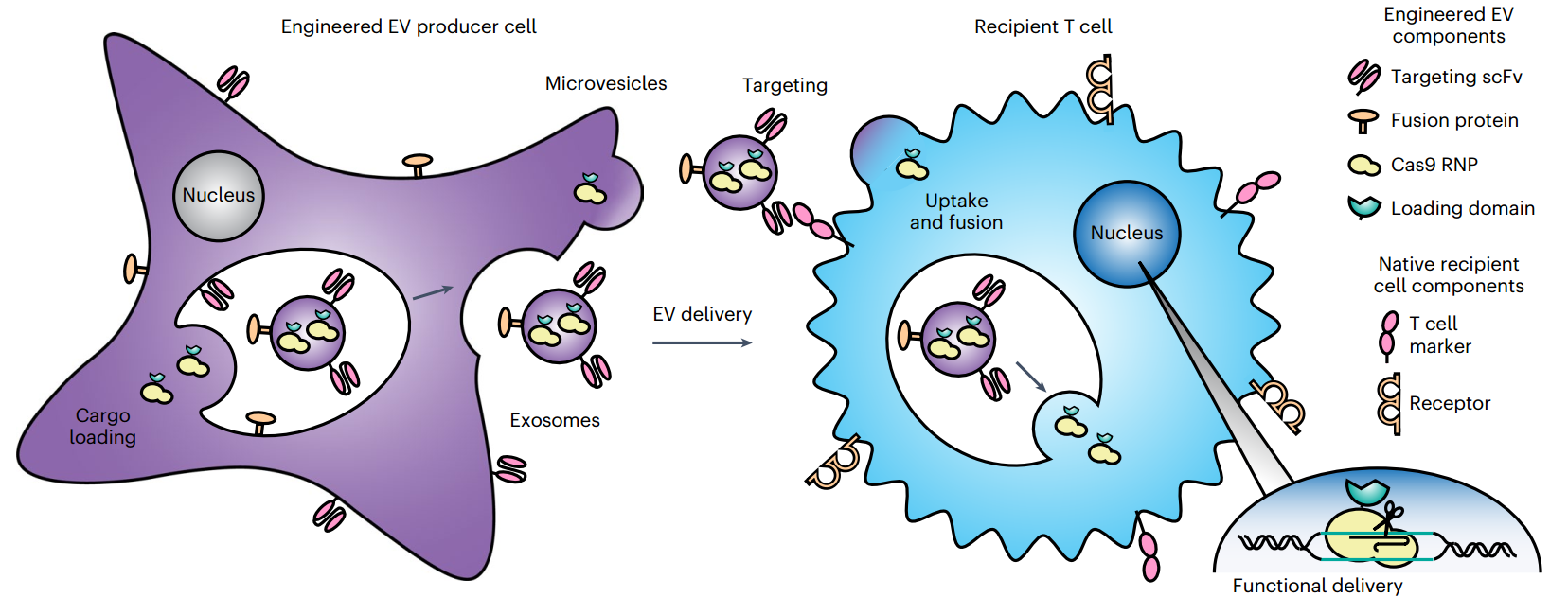
GEMINI基因工程多功能EV策略示意图
该研究通过开发一种综合的生物工程策略,用于基因工程细胞以指导多功能EV的自组装和生产,来解决这一需求。该研究系统地评估、比较和生成技术,使EV定位、蛋白质货物的积极装载和EV融合成为可能,以实现蛋白质货物对T细胞的功能性传递。这种探索确定了功能性EV介导传递的关键限制和驱动因素,包括一种潜在的受体结合介导的传递增强机制到T细胞。通过演示治疗相关的能力来验证这些技术——将Cas9核糖核蛋白复合物(RNP)递送到原代人类CD4+ T细胞中,以消除编码人类免疫缺陷病毒(HIV)共受体CXCR4的基因。
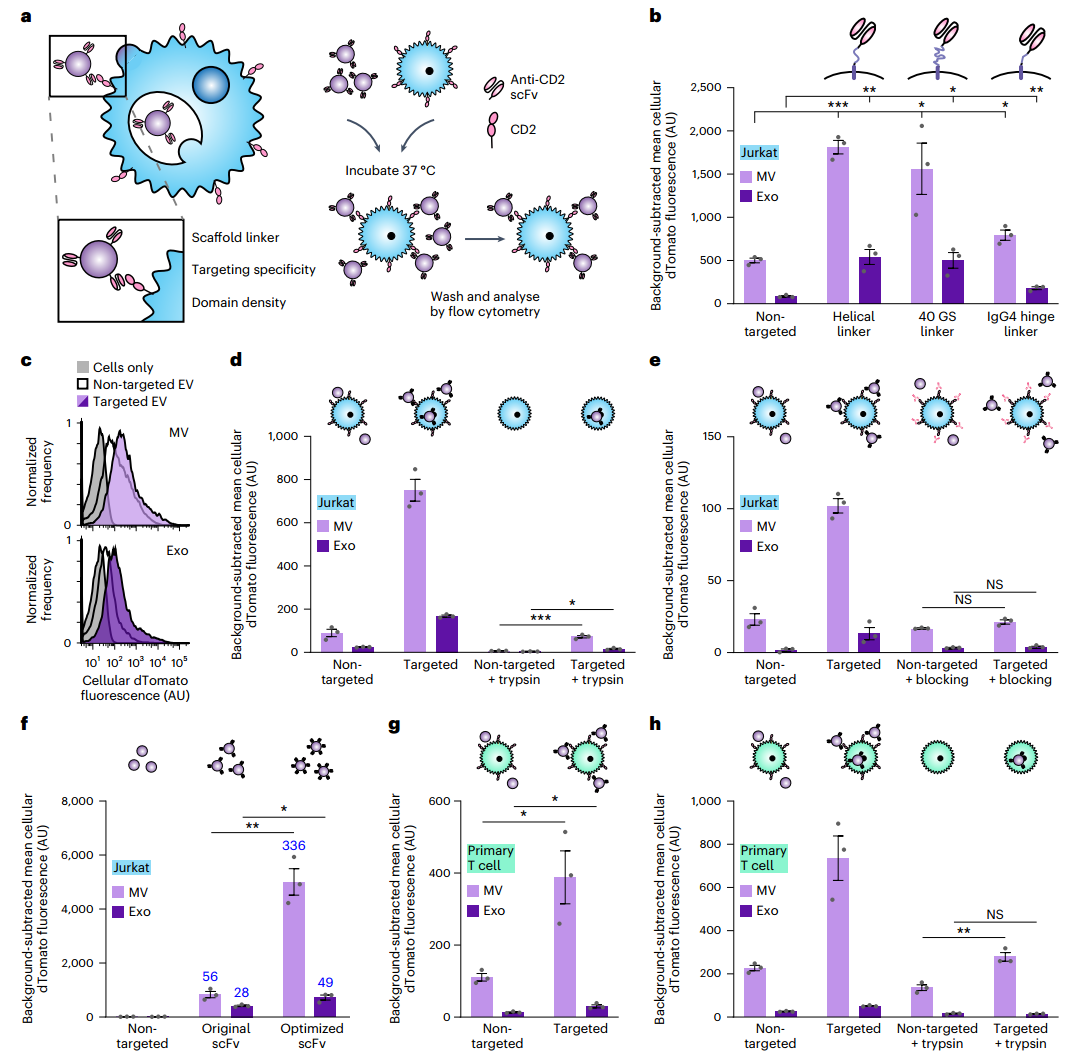
SCFv在EV上的展示可介导受体特异性、靶向结合和被T细胞的摄取
工程细胞通过蛋白标签积极装载蛋白质货物,并显示高亲和力的T细胞靶向结构域和融合型糖蛋白。通过工程EV验证了这些方法,将Cas9-sgRNA复合物递送到原代人类CD4+ T细胞中,以消除编码CXCR4的基因。该策略适用于将生物制品定向递送到其他细胞类型。
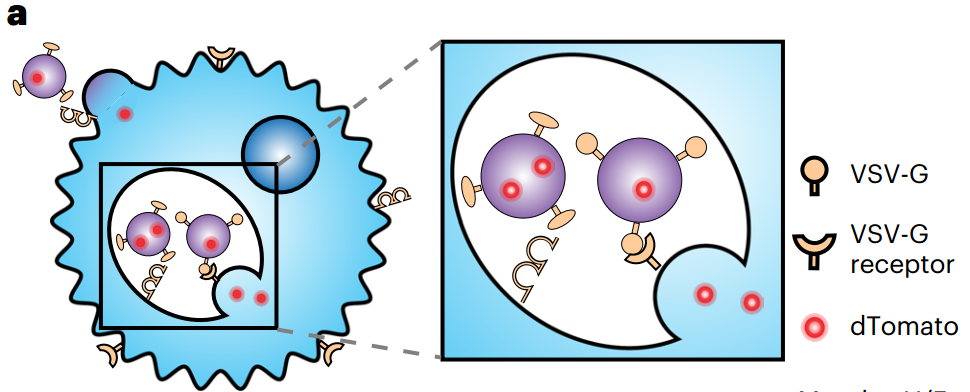
病毒糖蛋白促进 EV 在质膜或内体中的摄取和融合的图示
参考文献:
Stranford DM, Simons LM, Berman KE, Cheng L, DiBiase BN, Hung ME, Lucks JB, Hultquist JF, Leonard JN. Genetically encoding multiple functionalities into extracellular vesicles for the targeted delivery of biologics to T cells. Nat Biomed Eng. 2023 Nov 27. doi: 10.1038/s41551-023-01142-x. Epub ahead of print. PMID: 38012307.