传统的心血管疾病药物递送方法面临着重大的临床挑战。细胞源性纳米颗粒,也被称为细胞外囊泡,成为潜在的创新和有效的心脏治疗载体。
心力衰竭(HF)是一种严重的致死性疾病,其预后为4年内50%的死亡率,且缺乏特定的治愈性疗法。尽管现有疗法可以延长患者的生存时间,但并未提供治愈方法,因此,亟需促进心脏保护和修复的新策略。在各种新兴治疗方法中,包括基于细胞、再生和基因干预的非编码RNA靶向疗法、直接基于蛋白质的治疗方法成为一个特别有前景的途径。
目前心血管疾病的治疗面临着重大的药物递送挑战,特别是在直接将功能性修复分子(如蛋白质或RNA分子)递送到细胞内。尽管最近的临床前研究引入了新的治疗方法和分子,但已有的药物递送技术在临床环境中遇到了重大困难。这些困难包括:(i) 有效地针对特定器官内的疾病组织和细胞,(ii) 避免被免疫系统检测到,以及(iii) 确保治疗剂在细胞内的正确位置进行有效的细胞摄取和释放。这些障碍导致了器官和细胞的脱靶,需要免疫抑制策略,并且心血管护理中的治疗效果不佳。
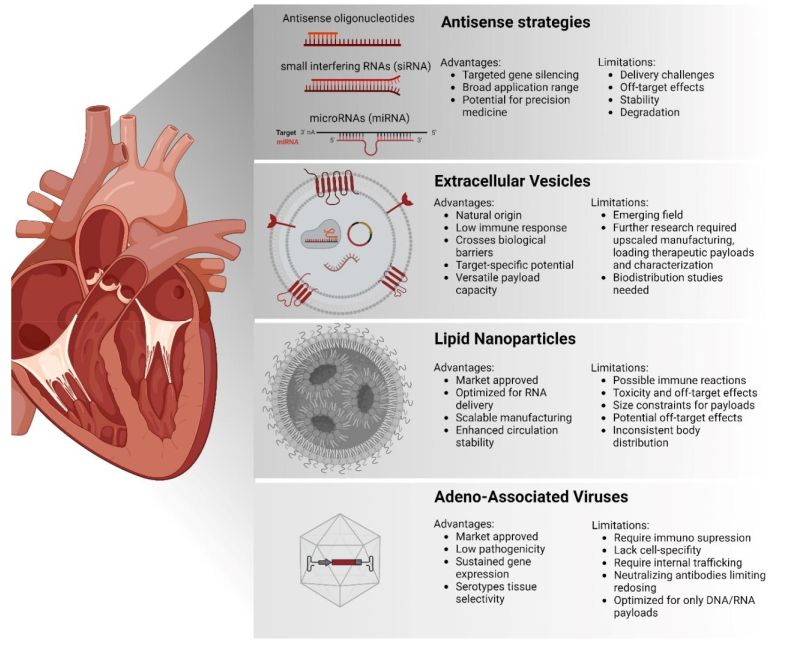
临床最先进的递送系统,可以诱导心脏保护或修复分子机制,包括通过反义策略进行的miRNA治疗,以及腺相关病毒(AAV)和脂质纳米颗粒(LNP)递送。AAVs,这些基于病毒的小型载体,因其低致病性和持续基因表达而备受青睐。然而,它们面临着免疫反应、高生产成本和有限遗传物质容量等挑战。此外,心脏组织中观察到基因转移有限,导致HF患者没有功能性益处,正如CUPID 2和SERCA-LVAD试验所观察到的那样。值得注意的是,AAVs可以激发免疫系统产生中和抗体,从而影响治疗效果,并限制其用于重复给药。对于慢性疾病,这一点尤为棘手,因为需要持续治疗。下图概述了不同的心脏靶向治疗策略,包括反义策略、细胞外囊泡、脂质纳米颗粒和腺相关病毒。
上图展示了心脏靶向治疗的四种主要方法,包括反义策略、细胞外囊泡、脂质纳米颗粒和腺相关病毒。
反义策略或基于脂质的LNP方法,将遗传物质封装在脂质中作为合成载体,在毒性和脱靶效应方面存在重大问题。在严重不良事件中提出了安全担忧,包括CRISPR基因编辑器传递试验中的一例死亡,可能是因为需要高剂量。虽然谨慎的剂量和使用特定AAV血清型可以提供组织选择性,有助于改善脱靶向效应,但在心血管患者护理中,迫切需要其他更安全、更精确和更有效的治疗选择,为未来在这一领域的进一步发展铺平道路。
细胞外囊泡
人体利用细胞外囊泡(EVs)进行高效且细胞特异性的细胞间通信。这些细胞源性的脂质双层包裹的纳米颗粒对于维持组织稳态至关重要。EVs代表了一种异质性的囊泡群体,包括外泌体和微囊泡,并且几乎所有细胞类型都会释放它们。它们将RNA、蛋白质和脂质运送到目标细胞,有助于细胞功能并传递警告信号。有趣的是,以前在心脏细胞为基础的治疗中观察到的旁分泌效应与注射的祖细胞释放的EVs有关。然而,由于供体细胞和EV处理方法的变异性,扩大EV的生产并在祖细胞来源的EVs中识别治疗分子具有挑战性。这种变异性在临床扩展中尤为关键,因为处理中的微小变化可能会显著影响EV的内容和性质。尽管如此,由于其自然功能和有效的细胞内路线,EVs在药物传递方面具有巨大的潜力,超越了当前的无细胞心脏再生治疗。
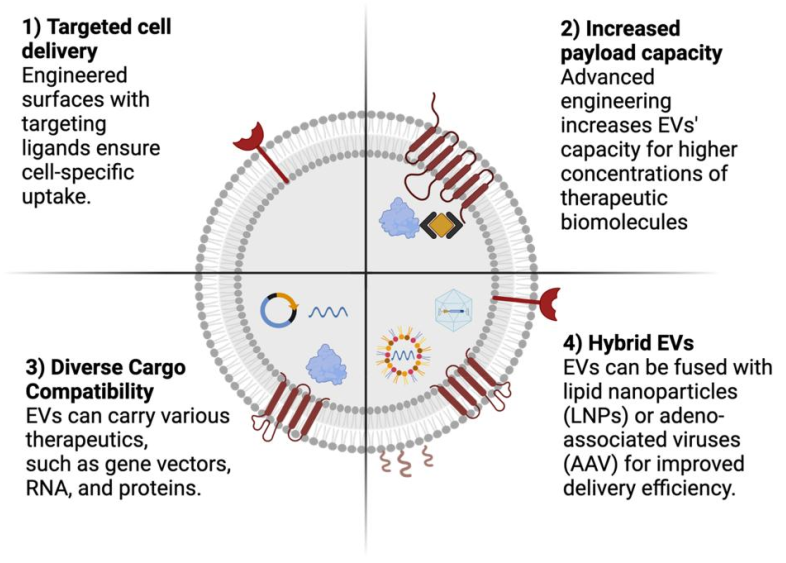
细胞外囊泡(EVs)作为药物递送系统的增强工程机会。将细胞外囊泡作为下一代靶向药物传递载体的发展可以通过进一步改进其潜力来实现,包括:(i) 通过表面修饰实现细胞特异性靶向,从而实现对目标细胞的精确药物传递,(ii) 优化工程技术,有效地将治疗剂加载到EVs的腔内,(iii) 促进多种治疗剂的细胞内传递,以及(iv) 通过将其与脂质纳米颗粒或腺相关病毒结合,创造新型混合EVs。
细胞外囊泡作为心脏药物递送载体
细胞外囊泡(EVs)作为天然的细胞间通信媒介的发现,已经引发了对其作为创新药物递送平台的探索。与AAVs和LNPs等传统系统相比,EVs在药物传递方面表现出几个理想的特性:EVs具有固有的细胞靶向能力,可以穿越生物屏障,如血脑屏障,并携带从基因载体到蛋白质的各种治疗荷载。尤其是当从自体细胞中获得时,它们的低免疫原性也是一个重要优势。EVs被认为利用了细胞内的自然过程,以实现对目标细胞的精确传递,以实现其高效的摄取,尤其是在细胞内的通路。 EVs与其合成对应物LNPs之间的直接体外比较表明,EVs的功能效率比LNPs高出一个数量级。结合了LNPs和EVs的优点,EV/LNP混合体具有改进的疗效和多样性,可用于治疗。进一步的研究探讨了EVs在传递CRISPR/Cas9核糖核蛋白复合物方面的能力,在体外和临床前模型中显示出对胆固醇管理和杜兴肌营养不良等疾病的潜力。
细胞外囊泡(EVs)的一个显著优势是其潜在的低免疫原性,这在各种临床试验中得到了证实,这些试验中EVs被用于免疫疗法,证明了在人类中使用EV的可行性。EVs在临床规模上的治疗药物递送潜力在很大程度上取决于克服特定的技术挑战,包括可扩展的分离技术、有效地将药物装载到EVs内部以及进一步改善器官靶向。了解EV生物学,尤其是EVs如何选择性地靶向细胞以及不同EV亚型的作用,对于将其发展为有效的药物载体至关重要,特别是对于心脏疾病。
综上所述,细胞外囊泡是传统心血管药物递送方法(如AAV和LNPs)的潜在替代品。它们的天然来源、靶向递送能力和克服生物障碍的能力强调了它们在心脏病治疗中的潜力。它们的多功能性在高级治疗递送中得到进一步证明,包括CRISPR/Cas9。解决EV分离、药物装载、生物分布和更详细地了解其生物学方面的挑战是充分利用其治疗潜力的必要条件。随着研究的进展,EVs可能会改变心脏药物递送,提供更安全、更有效的治疗选择。这一领域的未来发展对于充分发挥其在防治心血管疾病方面的潜力至关重要。
参考文献:
Ilahibaks NF, Lei Z, Sluijter JPG. Extracellular vesicles as vehicles for drug delivery to the heart. Eur Heart J. 2024 Mar 6:ehae099. doi: 10.1093/eurheartj/ehae099. PMID: 38447179.