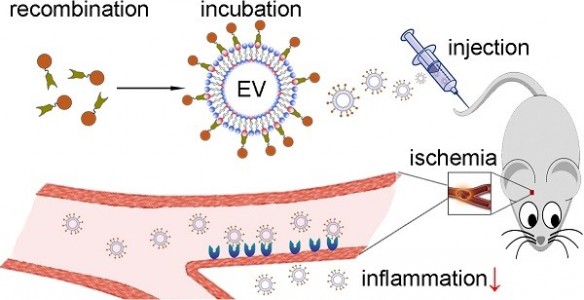
抗炎策略在缺血性中风后的再灌注期间能够预防脑损伤,源自干细胞的细胞外囊泡(EVs)是潜在的免疫调节中的治疗因子。但是,由于未修饰的EVs的靶向性差,因此直接的EVs静脉注射效果较差,而且干细胞衍生的EVs的大规模生产成本阻碍了临床应用。来自南京医科大学高隽教授的研究团队开发了一种RGD-C1C2融合蛋白修饰的EVs,能够靶向缺血性脑的病变区域并抑制了炎症反应,提出了一种潜在的缺血性中风治疗剂。该研究发表于Theranostics杂志上。
缺血性中风(Ischemic stroke)是全球范围内因病死亡的主要原因之一,也是导致后天致残的原因之一。不幸的是,针对缺血性中风的唯一批准的治疗方法是血管再通,但治疗窗口期很短(<4.5小时)。大量研究表明,抗炎症策略有望扩大治疗窗口期并防止再灌注期间的严重脑损伤。反映干细胞功能的源自干细胞的细胞外囊泡(EVs)已成为免疫抑制中的新型治疗物质。EVs可由所有生物系统中的细胞释放,载有蛋白质、编码和非编码的RNA以及DNA。作为天然的细胞穿梭体,EVs具有多种功能,包括低免疫原性、可生物降解性、包裹内源性生物活性分子的能力以及穿越血脑屏障(BBB)的能力。然而,未经修饰的EV在静脉内给药后迅速在网状内皮系统(RES)中积聚。整合素αvβ3在异常条件下(例如缺血再灌注和肿瘤进展)的血管生成过程中在内皮细胞上表达,但在正常组织的血管中却不表达,已被广泛研究作为诊断探针和治疗药物的靶标。Arg-Gly-Asp(RGD)肽是与整联蛋白αvβ3结合的众所周知的配体。基于RGD的纳米材料已被证明可以成功地将药物或造影剂输送至缺血脑组织。此前的研究已经开发了各种策略在EVs进行配体修饰。配体修饰的EVs是由工程供体细胞产生的。但是,这个过程很复杂,无法轻易应用于预分离的EVs。该研究团队此前开发了一种化学方法,可使用点击化学方法(叠氮炔炔环加成反应)将靶向肽缀合到EV表面上。这种策略使得配体在24小时内结合在预分离的EV上。Kooijmans等报道了一种诱人的策略,通过与EV膜上的磷脂酰丝氨酸(PS)的亲和力,以快速的“即插即用”方式将重组融合蛋白修饰在EV上。然而,这仅进行了原理验证实验,缺乏体内实验。干细胞来源的EVs临床转化的另一个障碍是生产相关的成本,因为大规模的EVs分离需要干细胞的补充(因为干细胞扩大培养能力的限制)和每批新批次的验证。ReN细胞是源自人类胎儿大脑腹侧中脑区域的神经祖细胞系,即使经过长时间传代(> 45传代),仍能保持正常的二倍体核型和分化能力。由于ReN细胞部分维持干细胞的特性,ReN细胞衍生的EVs(EVReN)可能具有抗炎特性。在这项研究中,研究人员在对脂多糖(LPS)刺激的BV2小胶质细胞中,发现EVReN表现出独特的抗炎作用。研究人员将乳粘附素(MFGE8)的C1和C2结构域(统称为C1C2)与PS结合,生成了RGD-4C重组肽(ACDCRGDCFC)与C1C2融合的蛋白肽(RGD-C1C2),并证明RGD-C1C2与EVs之间存在关联。在大脑中动脉闭塞(MCAO)和再灌注(MCAO / R)小鼠模型中,给予RGD-C1C2修饰的EVReN(RGD-EVReN),然后靶向缺血性脑的病变区域。此外,研究人员发现RGD-EVReN可有效抑制中风后炎症反应。EV的miRNA测序揭示了一组在EVReN富集的7个miRNA,可抑制有丝分裂原激活的蛋白激酶(MAPK)的信号传导(一种炎症相关途径)。总体而言,这些数据表明EVReN是一种新型的抗炎物质,将RGD-C1C2加入EVReN可以显著改善其靶向能力和对脑缺血的治疗功效。参考文献:Targeted delivery of neural progenitor cell-derived extracellular vesicles for anti-inflammation after cerebral ischemia.Theranostics. 2021 Apr 19;11(13):6507-6521.外泌体资讯网 南京医科大学:神经祖细胞来源的细胞外囊泡用于治疗脑缺血后的炎症反应