随着生物医学研究的不断深入,对于肿瘤的治疗策略也从非靶向的化疗、放疗逐渐过渡到了以靶向药物为主的针对肿瘤细胞关键分子靶标的靶向治疗策略。随之而来的问题是如何判断一个病人的肿瘤对特定治疗策略具有响应。目前,在实体瘤领域,检测靶向治疗效果的的主要策略是通过影像学、活检来检测肿瘤组织的变化,但是影像学的精准度低,活检对病人的伤害较大,因此亟待替代策略的开发。近日,来自新加坡国立大学的Shao Huilin团队开发了一个基于血液细胞外囊泡的平台,通过检测细胞外囊泡中蛋白的表达变化及药物与靶标分子的结合来推算靶向药物的治疗效果。这一成果对于非侵入性的药效评估策略具有重要的推动意义。该成果以“Extracellular vesicle drug occupancy enables real-time monitoring of targeted cancer therapy”为题,发表在近期的Nature nanotechnology上。
在过去的十年中,癌症治疗的范式已经从非特异性细胞毒剂演变为个性化,机制驱动的靶向治疗药物。与传统的化学疗法会干扰所有快速分裂的细胞不同,靶向疗法会与不同的分子靶标相互作用,而这些分子靶标对于肿瘤的存活至关重要,因此,可以引起可观的肿瘤消退。尽管靶向药物具有特定的性质,但目前在实体瘤中对其治疗的临床评估主要依赖于肿瘤体积成像,该成像有于多种原因而不能实时反映药物对肿瘤的治疗效果,观察到的变化通常也晚于药效的发挥,对药物-分子相互作用不敏感。
为了改善在分子水平上靶向治疗的评估,目前研究人员正在开发新的分析技术以测量特定药物与靶标之间的相互作用。例如,已经开发出热位移测定法,通过测量药物-靶标复合物的热稳定性变化来评估药物-蛋白质相互作用。由于这些变化是微妙的且非特异性的,因此该方法只能评估显示具有较大稳定性变化的高丰度蛋白质。化学蛋白质组学可以提高检测范围。这些测定法使用化学修饰的小分子探针来富集相互作用的蛋白质;然而,该方法需要大量的处理和大量的样品。由于这些分析技术的复杂性,在进行临床癌症治疗的患者中,药物与靶标的相互作用既不能被普遍测量,也无法进行纵向评估。在监测实体瘤中,由于需要重复进行侵入性组织活检,因此此类分析特别具有挑战性。因此,迫切需要开发一种基于血液的方法来表征药物-靶标相互作用以进行个性化治疗监测。
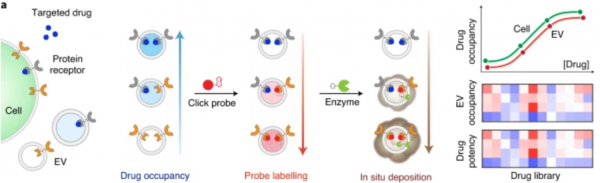
细胞外囊泡(EVs)最近已成为一种极具潜力的循环生物标志物载体。细胞外囊泡是由各种哺乳动物细胞,尤其是迅速分裂的癌细胞主动分泌的纳米级膜囊泡。这些囊泡在血液中大量存在,在介导细胞间通讯中起重要作用,它们包含大量从母细胞继承的分子内容物(例如蛋白质,核酸,脂质以及各种修饰)。基于最近有关药物结合靶标降解途径的研究结果,我们认为细胞外囊泡可能包含药物结合蛋白并反映细胞药物作用。因此,捕获这种EV信息库可能会提供一种基于血液的新方法,以分子方式表征特定的药物-靶标相互作用,这一技术理论上甚至可以用于实体瘤。
在这里,来自新加坡国立大学的Shao Huilin团队开发了一个纳米技术平台,该平台可对血液来源细胞外囊泡的特定亚群进行蛋白质表达变化和药物-靶标结合情况的同时评估,从而基于活性来测算药物东西学。该技术被称为小分子化学占有率和蛋白质表达的细胞外囊泡监测(ExoSCOPE),该技术利用生物正交探针扩增和等离振子谐振器内分子反应的空间模式来测量患者血液样本中的EV药物动力学。利用这种检测-传感器协同作用,该技术证明了对EV药物占有率的敏感检测(仅约1,000个囊泡)。通过测量EV亚群的药物动力学,我们开发了综合指标来实时反映细胞的药物占用和治疗效果。我们进一步将该技术应用于临床标本的快速多参数分析(1小时处理时间,5µl血浆样品;n = 106人和163个血浆样品)。与测量血液中总药物浓度的常规血液药代动力学/药效学(PK / PD)分析相比,ExoSCOPE分析不仅可以准确分类疾病状况,而且可以在治疗开始后24小时内有效区分治疗结果。
模式图
参考文献:Extracellular vesicle drug occupancy enables real-time monitoring of targeted cancer therapy