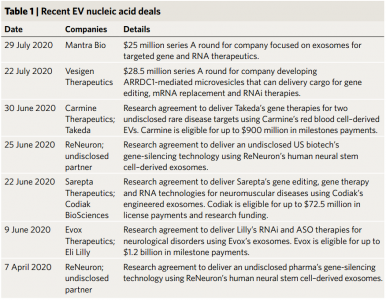
近日,Nature Biotechnology杂志(IF 36.558)online了一则news,报道了多家制药公司正在押注外泌体和其他细胞外囊泡,作为核酸药物递送的一种手段。一系列大型制药公司的交易表明,该行业正在拥抱外泌体,以将核酸药物递送至难以到达的组织。仅在6月,礼来、武田和拜耳就宣布了外泌体公司相关的超过10亿美元的交易(表1)。此外,近年来,一些新兴公司如雨后春笋般涌现,专注于开发治疗性外泌体或其他细胞外囊泡(EVs)作为基因和RNA药物的递送载体,因为它们的天然的核酸载体。外泌体是内体区室从细胞质中捕获多种分子(例如核酸、蛋白质和脂质)时形成的亚微米大小的囊泡。由于这些囊泡随后被细胞排出,因此曾经被认为是细胞垃圾囊,但现在被认为是细胞间通讯的机制。还可以工程化改造囊泡,即,通过离体加载特定分子或通过改造细胞以产生有效载荷来传递特定分子。多项交易表明,选择外泌体作为核酸载体的想法已受到制药公司的深度关注,因为最近宣布了四项合作,包括两项潜在价值近10亿美元的合作。其中最大的一笔交易是,礼来公司与英国牛津的Evox Therapeutics公司建立了合作伙伴关系。这笔交易可能带来高达12亿美元的里程碑付款,由Evox开发的靶向中枢神经系统(CNS)的外泌体将被礼来公司(Lilly)装载RNA干扰(RNAi)和反义寡核苷酸(ASO)药物,用于五个未公开的靶点研究(相关报道:https://www.exosomemed.com/7249.html)。根据Evox首席执行官Antonin de Fougerolles的说法,外泌体已经被证明可以穿越血脑屏障,但是该公司旨在通过将配体工程化到外泌体上来进一步改善CNS靶向。另外,Sarepta Therapeutics宣布与Codiak BioSciences达成一项协议,开发可携带Sarepta的基因疗法、基因编辑和RNA药物的外泌体。Codiak将获得研究资金,以及前期和短期许可付款,最高可达7250万美元(相关报道:https://www.exosomemed.com/7333.html)。Codiak也在今年10月份的首次公开募股中筹集了8300万美元(相关报道:https://www.exosomemed.com/7789.html)。Sarepta的Exondys 51(eteplirsen)和Vyondys 53(golodirsen)已获得美国食品药品监督管理局(FDA)的批准,这两种用于杜氏肌营养不良亚型的磷酸二胺吗啉代ASO疗法均通过静脉内输注进行。Sarepta公司首席医学官兼执行副总裁Gilmore O’Neill说,外泌体递送可以改善其ASO稳定剂以及其他基因疗法和基因编辑平台的收益/风险比。去年,FDA推迟了对Sarepta的Vyondys53的批准,理由是存在静脉输液端口感染的风险;ASO最终在12月获得批准。尽管在向眼睛、皮肤和肝脏输送核酸治疗剂方面取得了进展,但事实证明,人体中的其他组织更加困难。Alnylam Pharmaceuticals的Onpattro(patisiran)已率先成功在临床应用。Onpattro是首个获得FDA批准的短干扰RNA(siRNA)治疗药物,可治疗由运甲状腺素蛋白淀粉样变性引起的多发性神经病,并通过阳离子氨基MC3脂质纳米颗粒进行递送。但是,由于其潜在的免疫原性,Alnylam从那以后就不再使用纳米颗粒运载工具了。该公司获批的用于急性肝卟啉症的RNAi Givlaari(givosiran)是与N-乙酰半乳糖胺(GalNAc)偶联的,以靶向在肝脏中大量表达的去唾液酸糖蛋白受体。但是,Evox的de Fougerolles说,N-乙酰半乳糖胺结合物不会成为肝脏以外的解决方案。他说:“在每种组织中找到有效的定制分子或配体仍然是非常困难的情况。识别某些东西实在是一个艰巨的任务,到目前为止,肝脏之外还没有什么东西真的走得很远。”结合物(conjugates)的另一个靶标是运铁蛋白受体,其在脑、造血系统以及骨骼、心脏和平滑肌中高表达。由于转铁蛋白受体跨膜转运激素,因此已被用于将药物转运到细胞中。Dyne Therapeutics和Avidity Biosciences分别使用与ASO和siRNA偶联的抗体Fab片段靶向转铁蛋白受体。两家公司都于今年启动了首次公开募股,以推进骨骼肌疾病的临床前计划。牛津大学神经科学教授,Evox联合创始人Matthew Wood表示,即使公司能够克服寻找针对细胞类型的正确结合物和优化治疗方法的正确连接子的挑战,结合物仍然受到限制——他们可以传送的有效载荷的大小。O’Neill表示,除了已批准的ASO药物外,Sarepta还正在开发多种方法来减少其产品组合中的系统性暴露,这是该公司的首要任务。“所有反义化学物质对肾脏和肝脏都有先天的向性,而对肌肉则有较小的向性。外泌体(以及我们与Codiak达成的协议)之所以有吸引力的原因之一是,除了增强分子的组织渗透性并因此减少总体全身暴露外,我们还希望提高靶向的精确度。外泌体有可能同时做这两种事情。”Sarepta使用腺相关病毒(AAV)进行基因治疗。像脂质纳米颗粒一样,AAV载体具有免疫原性,并且它们可以携带的治疗性货物也限于~5 kb。同样,它们仅限于需要单剂量的治疗,这可能会使患者在以后的生活中无法接受第二种基于AAV的基因治疗。作为天然存在的纳米粒子,诸如外泌体的EV可避免免疫识别。而且,根据de Fougerolles的说法,在非人类灵长类动物中进行的测试表明,重复给药并不是外泌体的问题。Evox的数据显示,外泌体比单独注射寡核苷酸更可能在CNS中更好地递送siRNA货物。“如果将其与基因疗法进行比较,我们不仅可以重复给药,而且可以在第一时间到达更多的细胞。”然而,Carmine公司的Le说,外泌体并非没有安全隐患。那些以遗传方式操纵供体细胞以进行治疗或改善外泌体生产的公司会增加发生肿瘤的风险。“当您将病毒载体引入细胞时,这些病毒成分就会进入EVs。”Carmine的EV工程无需修饰供体细胞,而是使用酶将肽或单链抗体共价附于囊泡表面以修饰靶向性。Le说,Carmine的EV可以递送长达10 kb的DNA,大于AAV可以容纳的核酸。该公司尚未披露与武田公司合作探索的适应症,但Le的研究表明,源自红细胞的EVs可通过全身给药到达肝脏、脾脏、胃、肠、肾和肺。尽管行业兴奋,但仍存在EVs难以触及的组织,例如肺部。Le的论文显示,腹膜内注射的红细胞衍生的EV可以到达肺部,还有其他一些报道也表明EV可能在肺部疾病(包括哮喘、特发性肺纤维化、肺动脉高压和肺癌)中发挥作用。尚未有公司公开针对肺部治疗的EVs核酸疗法计划。Ludwig-Maximilians大学药物递送教授Olivia Merkel表示,EVs和其他纳米颗粒已显示在肺毛细血管中蓄积,这对于肺癌等适应症很有希望,但对于慢性阻塞性肺疾病或哮喘则较少。“如果微粒卡在毛细血管中,并且不能从血流中渗入肺组织,那么您可能看不到良好的治疗效果。”肺病有望利用核酸治疗,部分原因是肺组织中缺乏血清意味着核酸酶暴露率低,而且因为通过吸入制剂更容易进入肺部。最先进的核酸药物之一是用于肺移植患者呼吸道合胞病毒感染的RNAi治疗,Alnylam在2012年的2b期临床试验中未达到闭塞性细支气管炎综合征的主要终点后放弃使用。Merkel说,这种疗法是通过鼻腔给药的,这对任何疗法都是一个难题,主要是因为它的摄入量而不是吸入量。但她补充说,任何通过EVs进行的吸入式核酸疗法也都由于肺液而面临挑战:下肺部的表面活性剂会破坏脂质体和脂质纳米颗粒的稳定性。此外,上肺中的粘液粘度也存在类似的困难。除了鼻内给药外,更直接的肺部给药将需要雾化或干粉吸入器制剂,这两种方法均存在物理问题。Merkel说,干粉很难开发并且繁琐。她补充说:“许多这类纳米载体在雾化过程中无法承受绝对力。”Merkel预计病毒载体和外泌体也将面临类似的困难,尽管有动物数据显示,吸入雾化的外泌体可能对肺纤维化具有治疗作用。核酸疗法的另一个潜在靶标是心脏。Moderna和阿斯利康一直在研究使用编码血管内皮生长因子A的修饰RNA直接注射入心肌以治疗心肌梗死损伤的疗法。主要候选药物AZD8601正在芬兰、德国、瑞典和荷兰的心力衰竭早期2期试验中。迄今为止,自第一次CUPID试验以来,很少有针对心脏的临床核酸项目实例,该试验使用AAV-1通过冠状动脉内灌注向心力衰竭患者递送编码SERCA2a(肌浆/内质网Ca2+ATPase 2a)的基因。法兰克福歌德大学分子医学中心心血管再生研究所所长Stefanie Dimmeler表示,心脏组织并不是进行核酸治疗的一个特别具有挑战性的地方。但Wood说,鉴于有证据表明外泌体被心脏细胞吸收,因此有很强的动力来发展罕见遗传性冠心病的递递方式。到目前为止,该领域在探索EVs疗法方面一直是保守的,部分原因是学者和临床医生正在寻求针对高危患者的预防性疗法,因此首选一种对健康患者安全的行之有效的递送方法。他指出:“人们从事基因治疗病毒研究已有近40年的时间,而外泌体还不到10年。”外泌体资讯网 大型制药公司进军外泌体领域,用于药物递送 | Nature Biotechnology