作者:企鹅
包括小干扰RNA(siRNA)、反义寡核苷酸(ASO)和CRISPR-Cas9基因编辑guide RNA(gRNA)在内的RNA治疗药物正以新的方式高度特异、灵活地靶向患者基因组。尽管一些化学修饰的AOSs和siRNAs已经进入临床试验阶段,但由于当前递送载体的靶向性不好,所以目前仍局限于肝脏和中枢神经系统的疾病治疗。RNA药物递送(包括病毒,如腺病毒、慢病毒、逆转录病毒,脂质转染试剂和脂质纳米颗粒)的常用载体通常是具有免疫原性和/或细胞毒性的。因此,将RNA药物递送至大多数原发组织和癌细胞(包括白血病细胞和实体瘤细胞)的安全有效策略仍然难以实现。来自香港城市大学的黎月明博士(Dr Minh Le)研究团队希望利用真核生物的RNA交换和细胞间通讯的天然机制——细胞外膜泡(EVs)——作为RNA药物递送载体。Valadi等人首次在肥大细胞中发现了EVs对microRNAs和mRNAs的自然传递。随后,在许多其他细胞类型中也观察到这种现象作为细胞间信号传递的基本模式。EVs与哺乳动物细胞的天然生物相容性表明它可以克服大多数细胞屏障和药物输送障碍,如核糖核酸酶易感性、内体积累、吞噬作用、多药耐药性、细胞毒性和免疫原性。最近的研究成功地开发了电穿孔方法将siRNAs加载到EVs中导致强大的基因沉默效应。在神经元、癌细胞和血细胞中没有任何毒性。这表明EVs是新一代药物载体,能够开发安全有效的基因疗法。然而,由于EVs生产的限制,基于EVs的药物输送方法仍处于初级阶段。为了生产高纯度和高质量的EVs,我们需要严格的纯化方法,如蔗糖密度梯度超速离心或尺寸排阻色谱法,但它们耗时长且难以大规模操作。此外,产量非常低,以至于需要数十亿个细胞才能获得丰富的EVs,而且这么大量细胞通常获取困难。如果使用永生化细胞来替代生产EVs,致癌DNA和反转录转座子元件就有可能与RNA药物一起转移。实际上,所有有核细胞都存在一定程度的基因转移风险,因为我们并不能预测哪些细胞存在危险的DNA,哪些不存在。
因此,黎博士团队使用人类红细胞来生产用于RNA治疗的EVs,因为(i)红细胞缺乏核和线粒体DNA;(ii)红细胞是体内最丰富的细胞类型(占所有细胞的84%);(3)红细胞可以从任何人类受试者中很容易地获得,并且几十年来的常规输血应用已被是安全的。这项研究扩大了用于递送治疗性RNA的大量RBCEVs的产生。RBCEV介导的RNA药物递送在体外和体内介导白血病和乳腺癌细胞中的CRISPR-Cas9基因编辑的高效microRNA敲低和基因敲除,没有任何可观察到的细胞毒性。由于红细胞是没有DNA的无核细胞,RBCEVs不会造成任何水平基因转移的风险。总之,本研究展示了一种安全、可大规模操作且适用于任何基因治疗的简单有效的RNA药物递送平台。
论文思路:
- 首先对红细胞的EVs进行了鉴定,并证明了白血病细胞对RBCEVs的摄取。
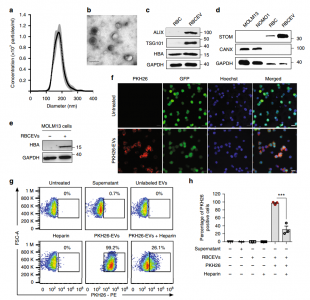
- 利用电穿孔将ASOs导入RBCEVs并递送至白血病细胞。
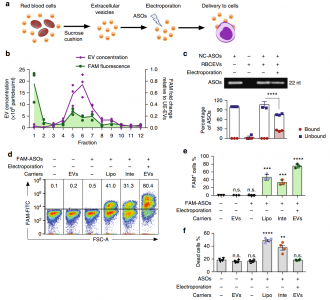
- RBCEVs将ASO递送至白血病和乳腺癌细胞,通过抑制miR-125b抑制了细胞的增殖。
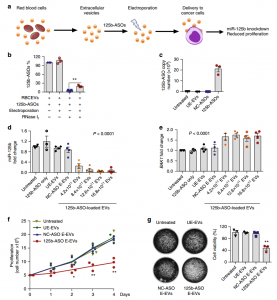
- RBCEVs在体内被乳腺癌细胞摄取
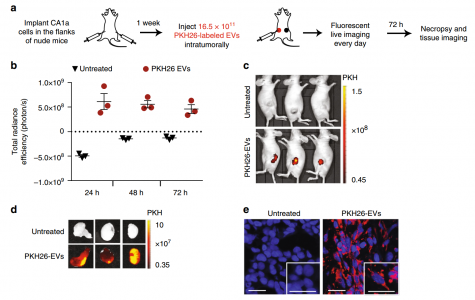
- 载有ASOs的RBCEVs治疗通过miR-125b敲除抑制肿瘤生长。
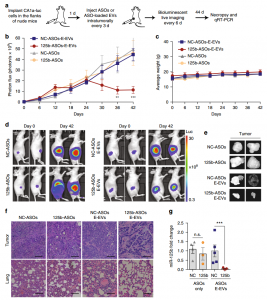
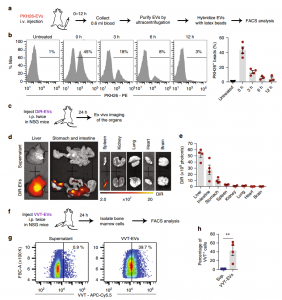
- NSG小鼠全身施用RBCEVs后的体内分布
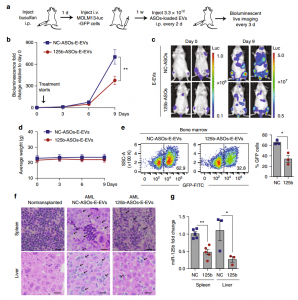
- RBCEVs中miR-125b ASOs系统性递送抑制AML异种移植小鼠模型中的白血病进展。
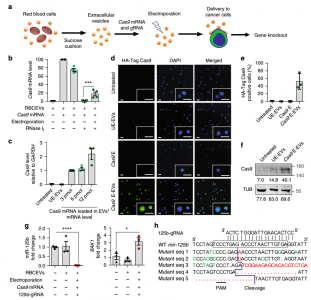
- RBCEVs将Cas9 mRNA和gRNA递送至白血病细胞并进行基因编辑。
综上所述,该研究的数据表明,RBCEVs可用作治疗性RNA的多功能递送系统,包括ASOs和gRNA等短RNA以及Cas9 mRNA等长RNA。该研究的RBCEV平台具有更多适用于临床应用的优势。首先,血液红细胞可以从现有的血库,甚至从患者自己的血液中获得。每个血液单位都有大量的红细胞(〜10^12个细胞/L)。因此,没有必要扩大培养中的细胞,并冒任何体外突变的风险,并且不需要cGMP合格的培养基或补充剂。其次,在用钙离子载体处理之后,可以从红细胞中纯化大量的(10^13-10^14)EVs,从而提供大规模获得EVs的策略。第三,RBCEVs是安全的,因为无核的RBCs缺乏DNA,与有核细胞类型的EVs不同,后者对基因转移构成潜在风险,而且血浆EVs同样具有很多不可预测内含物。对于癌症的治疗,RBCEVs比血浆EVs更安全,因为已知癌细胞和免疫细胞向癌症患者的循环中释放大量促癌的EVs。此外,与合成转染试剂不同,RBCEVs是无毒的。RNAs在RBCEVs中稳定并且在受体细胞中完全有功能。与慢病毒、腺病毒、腺相关病毒、纳米颗粒和大多数合成转染试剂不同,RBCEVs很可能是非免疫原性的,仅需通过匹配血型。该研究还发现,RBCEVs以比两种常用转染试剂更高的效率将RNA提供给细胞。RBCEVs不仅能够递送短链的RNA,而且能够递送长链的mRNA。RBCEVs成功用于靶向特定的oncomiR基因,不仅可以通过空间阻断,而且可以通过CRISPR-Cas9基因编辑,这些结果迄今尚未见报道。来自O-Rh阴性血液的RBCEVs对于通用治疗是理想的。最后,RBCEVs可以被冷冻和解冻多次而不影响它们的完整性和功效,这表明它们可以在未来发展成稳定的药物产品。用癌症靶向肽或抗体包被RBCEVs的进一步开发可能潜在地将治疗性RNA靶向递送至癌细胞,并减少正常组织中的不利副作用。
通讯作者简介:
Dr Minh Le (黎月明博士)
PhD (Singapore-MIT Alliance), Postdoc (Harvard Medical School)
Assistant Professor in the Department of Biomedical Sciences at City University of Hong Kong (CityU)
黎博士于2005年毕业于新加坡国立大学,获得生命科学学士学位。师从新加坡基因组研究所的Bing Lim教授和Whitehead生物医学研究所的Harvey Lodish教授,获得新加坡-麻省理工学院(MIT)联合的计算机和系统生物学博士学位。从2010年到2015年,曾在波士顿儿童医院和美国哈佛医学院Judy Lieberman教授实验室从事博士后研究。2015年8月加入香港城市大学生物医学科学系,担任终身助理教授。目前的研究兴趣集中在:确定EVs如何介导肿瘤细胞与微环境中其他细胞的相互作用以促进耐药性和癌症转移,以及开发基于EV的癌症治疗疗法。
参考文献:
Usman WM, Pham TC, Kwok YY, Vu LT, Ma V, Peng B, Chan YS, Wei L, Chin SM, Azad A, He AB, Leung AYH, Yang M, Shyh-Chang N, Cho WC, Shi J, Le MTN. Efficient RNA drug delivery using red blood cell extracellular vesicles. Nat Commun. 2018 Jun 15;9(1):2359. doi: 10.1038/s41467-018-04791-8.




