T细胞分化涉及FOXO1表达的动态调节,T细胞激活后FOXO1迅速下降并随后恢复。老年人的幼稚CD4 + T细胞反应中的重新表达受到损害。来自斯坦福大学的Jorg J. Goronzy教授课题组最新在ScienceAdvances杂志上发表文章,报道了FOXO1通过诱导溶酶体蛋白的关键转录因子TFEB来促进溶酶体功能。活化的CD4+T细胞中FOXO1的过度表达削弱了溶酶体的活性,导致多囊泡体(MVBs)的增加。MVB区室的扩大诱导糖原合酶激酶3β(GSK3β)的螯合,从而抑制蛋白质更新并增强糖酵解活性。结果,较老的活化的CD4+ T细胞发展出衰老细胞的特征。它们的细胞量增加,优先分化为短暂的效应T细胞,并分泌通过外泌体释放颗粒酶B伤害局部环境中细胞。
适应性免疫力下降与衰老相关,表现为对感染的易感性增加和疫苗接种的效力降低。迄今为止,人体研究未能发现单一的主要缺陷。由于胸腺退化而导致的T细胞生成的下降部分被维持一定规模且多样化的幼稚CD4+ T细胞的稳态增殖所补偿。CD8+ T细胞更受衰老影响,其中幼稚和中枢记忆亚群的减少以及效应T细胞的增加。终末分化的效应CD8+ CD45RA+ CD28- T细胞积聚,失去复制潜能,表达细胞因子、细胞毒性蛋白穿孔素和颗粒酶B,让人联想到先天的细胞功能和衰老相关的分泌表型(SASP)。较不常见的是,CD4+ CD45RA+ CD28-效应T细胞在老年人中积累。这些终末分化的T细胞还表现出降低的增殖能力和有效的效应子功能。除了这些效应T细胞通常对潜伏病毒具有特异性外,未经刺激的循环幼稚和记忆CD4+和CD8+ T细胞未显示出细胞衰老的证据,这些衰老可解释与年龄相关的免疫缺陷。由T细胞衰老诱导的表观遗传学特征和microRNA谱图显示了活化的分化途径,而不是衰老相关的缺陷,这些活化的分化途径有利于发育成短暂的效应细胞。除了细胞衰老和表观遗传学变化外,许多细胞途径也会导致衰老。普遍的衰老标志之一是蛋白质稳态(proteostasis)的丧失,即溶酶体或蛋白酶体降解错误折叠或破坏的蛋白质的缺陷。FOXO1是一种保守的长寿因子,它通过促进自噬和泛素-蛋白酶体系统中涉及的基因的表达,在许多细胞类型中维持蛋白稳态非常重要。在静息的T细胞中,FOXO1位于细胞核中,调节转录活性。T细胞活化诱导AKT介导的FOXO1磷酸化,出核,泛素-蛋白酶体降解,并因此终止转录调节活性。在以前的研究中,由于miR-21介导的PTEN表达降低,年龄较大的未成熟CD4+ T细胞在激活后表现出持续的AKT活性,导致效应子优先于记忆T细胞分化。AKT持续活化如何影响T细胞反应中FOXO1活性的动力学尚不清楚,但可能对蛋白稳定和分化产生影响。该研究表明,T细胞活化后FOXO1表达的动态调节通过溶酶体活性和外泌体分泌的调节影响蛋白质稳态。FOXO1诱导TFEB的转录,TFEB是溶酶体生物发生的主要转录因子。较老的幼稚CD4+ T细胞的反应的特征是在最初的激活诱导的下降后无法恢复FOXO1表达,从而导致溶酶体蛋白水解活性受损。取而代之的是增强了多囊泡体(MVBs)的形成,它是一种没有蛋白水解活性并且是外泌体的主要来源的酸性细胞器。糖原合酶激酶3β(GSK3β)被分选到MVB中,从而导致较老的幼稚CD4+ T细胞的细胞内GSK3β活性降低。持续的FOXO1抑制和相关的GSK3β螯合诱导蛋白质稳态中的衰老样缺陷,表现为细胞大小增加和外泌体分泌。糖酵解能力和糖原合成增加,并且T细胞功能偏向促炎性细胞因子的产生和外泌体中分泌的粒酶B的表达。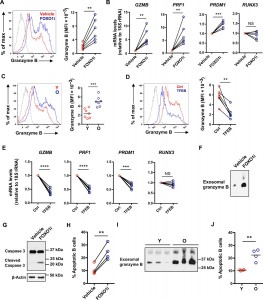
老年个体中FOXO1表达的减少有助于分化为表达粒酶B的效应细胞,并促进B细胞细胞毒性外泌体的分泌JunJin, Xuanying Li, Bin Hu, Chulwoo Kim, Wenqiang Cao, Huimin Zhang, Cornelia M.Weyand and Jorg J. Goronzy* FOXO1 deficiency impairs proteostasis in aged Tcells. Science Advances 22 Apr 2020: Vol. 6, no. 17, eaba1808
外泌体资讯网 Science子刊:外泌体参与FOXO1缺乏导致的老年T细胞蛋白稳态受损