免疫突触是促进从抗原呈递细胞(APC)到T细胞的三种激活信号(即抗原、共刺激/共抑制和细胞因子)传递的分子中枢。T细胞释放第四类信号实体,跨突触小泡(tSV),以介导双向通信。来自牛津大学的研究人员在Nature Communications杂志上发表文章,报道发现跨突触小泡(tSV)与常规EV的不同特点。
T淋巴细胞是调节和促进适应性免疫的关键因素。辅助性T细胞(TH)、细胞毒性T淋巴细胞(CTL)和调节性T细胞(Treg)通过称为免疫突触(IS)的细胞界面与抗原呈递细胞(APC)和其他T细胞的接触形成细胞网络。这些IS能够实现三个关键受体配体驱动的信号,这些信号对于启动免疫反应或维持自身耐受至关重要:(1)抗原识别,(2)共刺激和共抑制,以及(3)感知释放到突触间隙的可溶性细胞因子。该研究提出了第四种基于跨突触超分子效应器的跨突触信号,并提供了一种通用工具来研究这些具有挑战性的独立信号实体。在过去的10年中,已经确定了几种通过细胞-细胞连接界面传递信息的超分子效应器。这些包括极化外泌体(PE)、从多泡体释放到突触间隙中的超分子攻击粒子(SMAP)、从T细胞质膜穿过突触间隙出芽的突触外体(SE)和反式内吞作用/吞噬作用跨突触间隙的膜碎片。PE和SE是供体T细胞通过内体分选复合物转运(ESCRT)机制主动形成的细胞外囊泡,共同构成跨突触小泡(trans-synaptic vesicles, tSV)。SMAP是大小与外泌体和SE相似的蛋白质颗粒,但缺乏磷脂膜,而是具有能够转移复杂货物的核壳结构。对抗原传感的要求和多个近分泌信号的整合(即,通过相对细胞膜的纳米接近实现的反式受体-配体相互作用)使得跨免疫突触的超分子效应器能够进行高度调节和有效的交换。在抗原依赖性接触中,T细胞早在相互作用10-30分钟时就有效地将含有T细胞抗原受体(TCR)的细胞外囊泡转移到APC。同样,CD40配体(CD40L)对B细胞的帮助和生发中心反应的启动至关重要,它以接触、CD40和抗原依赖性方式从T细胞转移到B细胞。免疫突触(IS)的特殊分子和细胞器组织还能够以抗原依赖性方式将microRNA(miR)传递到APC,突出了免疫突触(IS)作为各种细胞间信息的促进者的关键作用。然而,由于APC对跨突触货物的快速内化,以及由于参与接触的细胞通过跨内吞作用和吞噬作用主动获取膜碎片,对跨突触颗粒进行更详细的表征仍然具有挑战性。在识别T细胞特异性颗粒效应物时完全引入了混杂因素。虽然tSV、反式内吞片段和SMAP被突触伙伴消耗,但可以从活化T细胞的培养上清液中收集由ESCRT机制形成并组成性释放到培养基中的细胞外囊泡(本文称为EV)。以前的工作使用EV作为tSV的替代品。虽然这种方法具有一定的预测能力,但tSV和EV的比较对于细胞间通信领域的进展至关重要。该研究开发了一个平台来专门收集从三种主要类型的T细胞释放的tSV,研究它们的调节并将它们的免疫受体、蛋白质和miR货物与EV的那些进行比较。研究结果揭示了tSV中独特的调节和组成特征,并支持调节细胞间接触(例如免疫突触)促进颗粒信使交换的观点。该平台还应该有助于在其他生物细胞-细胞连接中捕获tSV,并响应可以用支持的脂质双层(SLB)建模的各种近分泌(juxtacrine)信号。
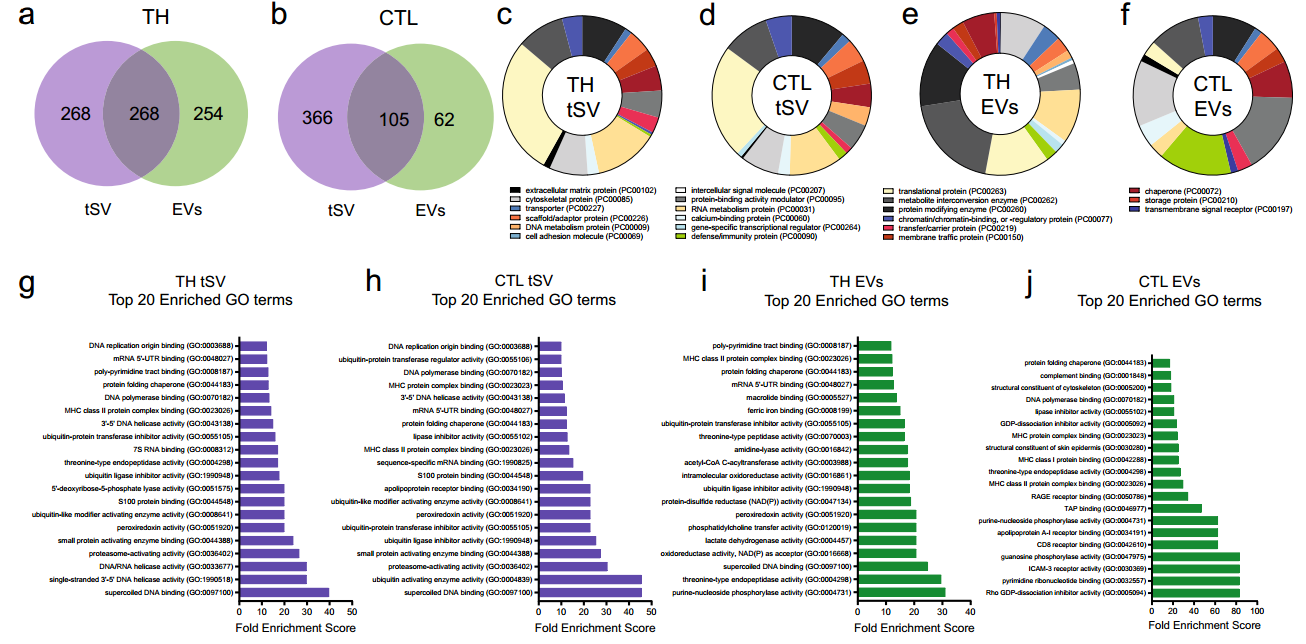
tSV 富含与泛素化和RNA结合蛋白相关的蛋白质
研究将珠支持的脂质双层(BSLB)作为多功能合成APC来捕获、表征和促进对tSV生物发生的理解。具体来说,CD40和抗原等近分泌信号的整合导致tSV的适应性剪裁和释放,与稳定释放的细胞外囊泡(EV)相比,tSV在大小、产量和免疫受体货物方面有所不同。专注于CD40L+tSV作为模型效应器,研究表明PD-L1与TSG101、ADAM10和CD81的反式呈递是决定CD40L囊泡释放的关键。最后,与EV相比,研究发现tSV中的RNA结合蛋白和microRNA含量更高,这支持了tSV作为细胞间信使的特殊作用。参考文献:Céspedes PF, Jainarayanan A, Fernández-Messina L, Valvo S, Saliba DG, Kurz E, Kvalvaag A, Chen L, Ganskow C, Colin-York H, Fritzsche M, Peng Y, Dong T, Johnson E, Siller-Farfán JA, Dushek O, Sezgin E, Peacock B, Law A, Aubert D, Engledow S, Attar M, Hester S, Fischer R, Sánchez-Madrid F, Dustin ML. T-cell trans-synaptic vesicles are distinct and carry greater effector content than constitutive extracellular vesicles. Nat Commun. 2022 Jun 16;13(1):3460. doi: 10.1038/s41467-022-31160-3. PMID: 35710644; PMCID: PMC9203538.





